FUVEST - Química - Equilíbrio - RESOLUÇÃO
1 - (2003) Em uma experiência, aqueceu-se, a uma determinada temperatura, uma mistura de 0,40 mol de dióxido de enxofre e 0,20 mol de oxigênio, contidos em um recipiente de 1L e na presença de um catalisador. A equação química, representando a reação reversível que ocorre entre esses dois reagentes gasosos, é 2 SO2 (g) + O2 (g)⇌ 2 SO3 (g). As concentrações dos reagentes e do produto foram determinadas em vários tempos, após o início da reação, obtendo-se o gráfico:
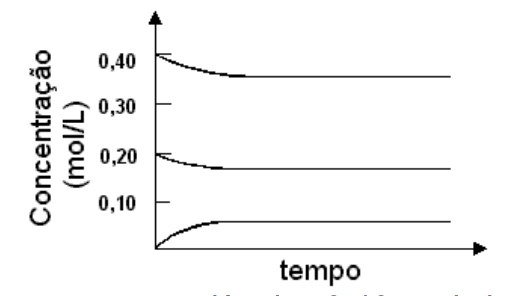
Em uma nova experiência, 0,40 mol de trióxido de enxofre, contido em um recipiente de 1L, foi aquecido à mesma temperatura da experiência anterior e na presença do mesmo catalisador. Acompanhando-se a reação ao longo do tempo, deve-se ter, ao atingir o equilíbrio, uma concentração de SO3 de aproximadamente
a) 0,05 mol/L b) 0,18 mol/L c) 0,20 mol/L d) 0,35 mol/L e) 0,40 mol/L
Resolução:
Trata-se do equilíbrio na reação: 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g) .
Essa questão não exige cálculos, apenas um conhecimento do conceito de equilíbrio químico. Mais especificamente, do fato de que o equilíbrio na reação é sempre o mesmo, não importa se inicia-se a reação com os reagentes ou com os produtos. Como a reação ocorre simultaneamente nos dois sentidos (o equilíbrio é dinâmico), os reagentes viram produtos e vice-versa e o equilíbrio é eventualmente alcançado (chamo de reagentes as substâncias à esquerda das flechas).
Neste caso são dadas informações para o equilíbrio iniciado com os reagentes (2 SO2 (g) + O2 (g)) e depois perguntado o que acontece se inicia-se apenas com o produto (2 SO3 (g)). A resposta é que dá no mesmo.
Para obter o número desejado olhamos no gráfico. A concentração de SO3 (g) é aquela que incia-se do zero (no primeiro caso em que há apenas reagentes) e portanto a linha inferior. A concentração é portanto 0,5 mol/l .
Catalisadores não interferem no equilíbrio; eles apenas aceleram a reação e portanto o equilíbrio é alcançado mais rapidamente. Este fato é muito cobrado nas provas.
2 - (2005) O Brasil produz, anualmente, cerca de 6 x 106 toneladas de ácido sulfúrico pelo processo de contacto. Em uma das etapas do processo há, em fase gasosa, o equilíbrio 2 SO2 (g) + O2 (g) ==> 2 SO3 (g) , KP = 4,0 x 104 que se estabelece à pressão total de P atm e temperatura constante.
Nessa temperatura, para que o valor da relação x2 SO3 / x2 SO2 x2 O2 seja igual a 6,0 x 104 , o valor de P deve ser
a) 1,5 b) 3,0 c) 15 d) 30 e) 50
x = fração em quantidade de matéria (fração molar) de cada constituinte na mistura gasosa
KP = constante de equilíbrio
Resolução:
-Aqui é exigido o conceito de fração molar e a fórmula para a constante de equilíbrio baseada em pressões parciais (KP).
KP é similar à Kc , que é a constante de equilíbrio baseada nas concentrações. A diferença é que entram os valores de pressão parcial invés de concentração, portanto :
P2 SO3 / P2 SO2 P2 O2 = 4,0 x 104 (I)
A pressão parcial de cada gás na mistura é proporcional à sua fração molar (x), ou seja:
Pa = xa * P (II)
onde Pa é a pressão parcial do gás a e P é a pressão total
-Entendido isso, pode-se começar a calcular:
Substituindo a expressão (II) na (I):
x2 SO3 P2 / x2 SO2 P2 x2 O2P2 = 4,0 x 104
(x2 SO3 / x2 SO2 x2 O2) (1/P) = 4,0 x 104
4,0 x 104 * P =6,0 x 104 ==> P = 1,5
Resposta: a)
3- (2000) Considere o equilíbrio, em fase gasosa,
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
cuja constante K, à temperatura de 430 ºC, é igual a 4. Em um frasco de 1,0 L, mantido a 430ºC, foram misturados 1,0 mol de CO, 1,0 mol de H2O, 3,0 mol de CO2 e 3,0 mol de H2 . Esperou-se até o equilíbrio ser atingido.
a) Em qual sentido, no de formar mais CO ou de consumi-lo, a rapidez da reação é maior, até se igualar no equilíbrio? Justifique.
b) Calcule as concentrações de equilíbrio de cada uma das espécies envolvidas (Lembrete: 4 = 2 2 ).
Resolução:
a) para descobrir o sentido de maior velocidade de reação, usa-se o quociente de reação (Q). Este é similar à constante K, mas usam-se as concentrações de estados fora do equilíbrio. No caso de equilíbrio, Q=K.
Usando -se as concentrações dadas na questão (ver planilha abaixo), Q = 3*3/1*1 = 9.
Como este valor é maior que o de K, a reação reversa (da direita para a esquerda) é a de maior velocidade nesse momento, pois as concentrações do lado direito devem diminuir, e as do lado esquerdo aumentar, para que se alcance o valor de K para esta expressão.
b) Na planilha estão as concentrações de equilíbrio em termos de x. Colocando estas na expressão de K, e igualando ao seu valor que é conhecido, podemos equacionar para descobrir x e portanto as concentrações de equilíbrio:
(3-x)2 / (x+1)2 = 22 ==> (3-x)/ (x+1)= 2 ==> 3-x = 2x+2 ==> -3x = -1 ==> x=1/3
Dessa forma as concentrações de equilíbrio são:
[CO] = [H2O] = 4/3 mol / l
[CO2] = [H2] = 8/3 mol / l
4 - (2003) Cobalto pode ser obtido a partir de seu óxido, por redução com hidrogênio ou com monóxido de carbono. São dadas as equações representativas dos equilíbrios e suas respectivas constantes a 550°C.
I. CoO(s) + H2(g) ⇌Co(s) + H2O(g) K1 = 67
II. CoO(s) + CO(g) ⇌ Co(s) + CO2(g) K2 = 490
a) Mostre como se pode obter a constante (K3) do equilíbrio representado por CO(g) + H2O(g) ⇌ CO2(g) + H2(g) a 550°C, a partir das constantes dos equilíbrios I e II.
b) Um dos processos industriais de obtenção de hidrogênio está representado no item a. A 550°C, a reação, no sentido da formação de hidrogênio, é exotérmica. Para este processo, discuta a influência de cada um dos seguintes fatores: – aumento de temperatura. – uso de catalisador. – variação da pressão.
Resolução:
a) É preciso manipular e adicionar as reações I e II para se obter a equação de interesse. Isso é feito por tentativa e erro.Até se chegar ao resultado desejado.
Com queremos H2O(g) do lado esquerdo, eu começo por inverter a reação I e em seguida adicioná-la À reação II (devo lembrar que mudanças de sinais e cancelamento de termos ocorre aqui da mesma forma que na álgebra):
Co(s) + H2O(g) ⇌ CoO(s) + H2(g) K1-reversa = 1/67
CoO(s) + CO(g) ⇌ Co(s) + CO2(g) K2 = 490
-----------------------------------------------------------------
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
(os termos CoO(s) e Co(s) foram cancelados por que encontram-se dos dois lados )
K para a reação obtida é dada pelo produto das K's das reações que foram somadas, portanto:
K = K1-reversa * K2 = 490/67 = 7,3
b) Segundo o princípio de Le Chatelier, a reação se ajusta para minimizar uma mudança nas suas condições.
Foi informado que a reação é exotérmica portanto , para minimizar a influência de um aumento de temperatura, a reação deve ocorrer predominantemente no sentido reverso (endotérmico) de modo a absorver o calor fornecido.
O uso de catalisador nunca afeta a constante de equilíbrio.
Uma variação depressão não afeta o equilíbrio nesse caso, porque há o mesmo número de moles de gás em ambos lados.
Questões da FUVEST em outros tópicos>>
