Gases industriais provocam reações na parte alta da atmosfera que destroem o ozônio, o gás que nos protege dos raios UV, provenientes do Sol, que são letais...
A destruição da camada de ozônio é um problema grave porque o ozônio absorve parte da radiação ultravioleta (UV) incidente no planeta e portanto nos protege desta . Raios UV causam problemas em animais e plantas; em humanos podem causar câncer.
A molécula de ozônio, que reside principalmente nas camadas mais altas da atmosfera (estratosfera) , consiste de 3 átomos de oxigênio, enquanto a molécula de oxigênio possui 2. Quando o ozônio é destruído, formam-se moléculas de oxigênio:
O + O3 → 2 O2
O buraco de ozônio
Na região da atmosfera sobre a Antartica (polo sul) há uma grande redução na quantidade de ozônio e saí o nome buraco de ozônio. No polo norte também há um buraco, mas muito menor. A destruição do ozônio em outras regiões do planeta também ocorre, mas é bastante menor que nesses dois casos mencionados.
O mecanismo de destruição do ozônio
A destruição do ozônio ocorre coma presença de catalisadors (substâncias que facilitam e aceleram uma reação química) do tipo radical livre, que são moléculas que possuem um elétron não-emparelhado que é representado por um ponto: OH· , NO·, Cl· , Br· . Radicais livres são extremamente reativos . Destes, os mais comuns na estratosfera são o Cl· e Br·, ambos resultado da ação humana (antropogênicos).
Existe também a liberação de cloro para a atmosfera de forma natural, como por exemplo nos sprays de água do mar (que contém sal – NaCl), mas neste caso o cloro dificilmente sobrevive até chegar na atmosfera pois ele reage quimicamente com outras substâncias na atmosfera.
Mas existe um grupo de substâncias produzidas industrialmente, que é estável o suficiente para fazer a longa viajem até a estratosfera e permanecer por ali. Aliás , é esta estabilidade , aliada a outras caracteríticas desejáveis como a baixa flamabilidade e toxicidade, que tornou este gás o favorito em aplicações diversas como sistemas de refrigeração, propelente de latas de aerossol e até aplicações medicinais.
Os CFC´s foram usados durante muito tempo, sem que se conhecera o seu potencial para destruir a camada de ozônio. Grandes quantidades destes gases reside na estratosfera, apesar da proibição do seu uso com o protocolo de Montreal (1987).
Além disso, os CFC’s causam efeito estufa (greenhouse gas).
CFC significa clorofluorocarboneto. São moléculas derivados do metano e do etano, em que átomos de hidrogênio são substituídos por átomos de cloro e de flúor. Existem diversos tipos, já que todas as possíveis combinações foram testadas. Há alguns tipos em que existem átomos de hidrogênio também.
Por exemplo, na imagem abaixo se vê o CCl2F2 (com nome comercial freon 12), uma molécula derivada do metano em que os 4 hidrogênios foram trocados por 2 cloros e 2 flúores.
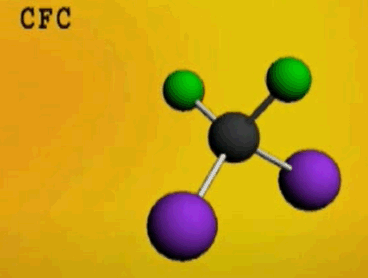
imagem retirada do meu vídeo sobre aquecimento global: https://www.youtube.com/watch?v=3szR-xQF4CA&t=187s
O problema é que a ligação C-Cl pode ser rompida pelos raios UV. Este é um processo fotoquímico (photos – luz). Ou seja, a luz pode promover reações químicas. Um exemplo infeliz é no caso do UV incidindo sobre a molécula de DNA, causando modificações que podem levar à destruição da célula ou ao câncer. Quando as cores de roupas e quadros desbotam no sol, trata-se de outro processo químico causado pela energia do raio UV.
A eletricidade também promove reações químicas, estudadas em eletroquímica, e a pilha é um bom exemplo. Tanto a luz como a eletricidade transportam energia, que é o que faz as coisas acontecerem (essa é minha definição de energia).
O CFC abaixo é conhecido como freon 11. Com a incidência do raio UV, um átomo e cloro é liberado na forma de radical livre, que é algo extremamente reativo:
Quebra da ligação C-Cl:
CCl3F → CCl2F + Cl·
Radical livre ataca o ozônio:
Cl· + O3 → ClO + O2
Produto da reação anterior ataca o ozônio e regenera o Cl· :
ClO + O3→ Cl· + 2 O2
Dessa forma o Cl· é regenerado para reiniciar este ciclo de 2 etapas.
Porque sobre a antártica?
Como mencionado acima, o Cl· age como catalista e portanto ele não é consumido na reação. (a reação só involve átomos de oxigênio) e permanece no ambiente causando mais e mais destruição. Um único Cl· pode destruir cerca de 100 mil moléculas de ozônio (ref livro gringo), até que ele se trombe com alguma outra substância e forme algo diferente, deixando o ozônio em paz.
Para que esta destruição acelerada ocorra, são necessárias certas condições que ocorrem apenas nos polos onde, devido às baixas temperaturas, forma-se um tipo especial de nuvens (PSC’s). Em outras regiões do planeta o Cl· não é tão eficiente no processo de catálise, e portanto a destruição é pequena.
Mais informações:
-No polo temos 6 meses de noite e 6 meses de dia. A destruição ocorre somente nos 6 meses de dia, pois é necessário o raio UV que vem do sol.
- o ozônio é muito útil lá na estratosfera, pois nos protege do UV, mas não o queremos por perto porque é veneno para nós. No entanto ele existe na atmosfera que respiramos e é considerado poluição.
- na atmosfera primitiva , a cerca de 3,5 bilhões de anos atrás , não existia oxigênio e portanto não havia ozonio. Quando as cianobacterias começaram a fazer fotossíntese a atmosfera passou a conter oxigênio, que era um veneno até que a vida evoluiu para defender-se dele e fazer uso na respiração celular.
Por isso a irradiação UV era muito intensa, mas como a vida começou no mar a água fornecia uma blindagem.
índice de química ambiental >>
