Química > Básica > Diagramas de Lewes
Estes são muito úteis para representar elétrons de valência (os que fazem a química) e também ligações covalentes, onde eles mostram a formação dos octetos (oito elétrons na última camada) combinando elétrons de mais de um átomo
Representação de átomos
Exemplo - átomo de sódio: Vemos na imagem abaixo que ele possui apenas 1 elétron de valência. Sua representação de Lewes será então:

átomo de sódio mostrando seu único elétron de valência
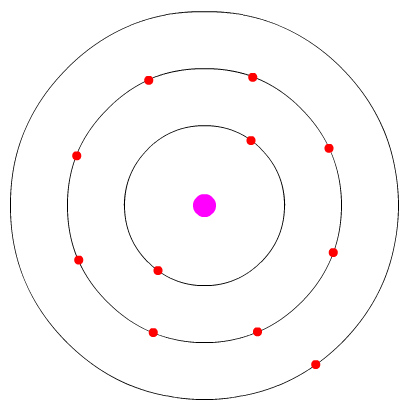
Exemplo - átomo de bromo: Este possui 7 elétrons de valência (ver átomo abaixo):
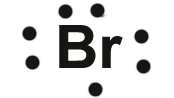
representação de Lewes do átomo de bromo
átomo de bromo mostrando 7 elétrons de valência
Representação de moléculas
A ligação covalente entre 2 átomos de oxigênio para formar a molécula é representada assim:

Os elétrons compartilhados são colocados no espaço entre os átomos. Esta ligação pode ser representada também assim: H-H, onde o traço representa o par de elétrons.
Animação da formação da molécula
O bromo também necessita compartilhar apenas 1 par de ele´trons para alcançar o octeto.

A molécula de bromo poderia ser representada também assim: Br-Br
Já o carbono (4 elétrons de valência) e o oxigênio (6 elétrons de valência) necessitam compartilhar 2 pares de elétrons. Isto ocorre na formação do CO2 :

O CO2 pode também ser representado assim: O=C=O , onde o traço duplo significa ligação dupla.
© Ricardo Esplugas de Oliveira, 2020
