Química > Básica > Estrutura do átomo
O átomo é como um sistema solar submicroscópico, onde elétrons se movem em órbitas ao redor do núcleo. Toda a química depende apenas dos elétrons mais externos, e por isso temos que saber como se comportam.
O átomo consiste de 3 tipos de partículas básicas, prótons, nêutrons e elétrons. Ele possui um núcleo (constituído de prótons e nêutrons) e elétrons se movendo ao seu redor. O núcleo tem carga elétrica positiva (prótons são positivos e nêutrons neutros) e por isso atrai os elétrons que são negativamente carregados. O núcleo é muito mais pesado que os elétrons. Os elétrons movem-se a grande distância do núcleo, de modo que o espaço interno do átomo é bastante vazio (na ilustração abaixo são mostrados os elétrons próximos do núcleo para possibilitar o desenho do modelo). Este fato surpreendente foi descoberto por Rutherford, físico inglês do início do século XX. Eu produzi uma simulação visual deste experimento, com explicações mais detalhadas, que pode ser vista aqui:
Simulação: experiência de Rutherford >>
Um modelo (aprenda mais sobre modelos científicos aqui) útil para estudar o átomo é o das órbitas circulares:
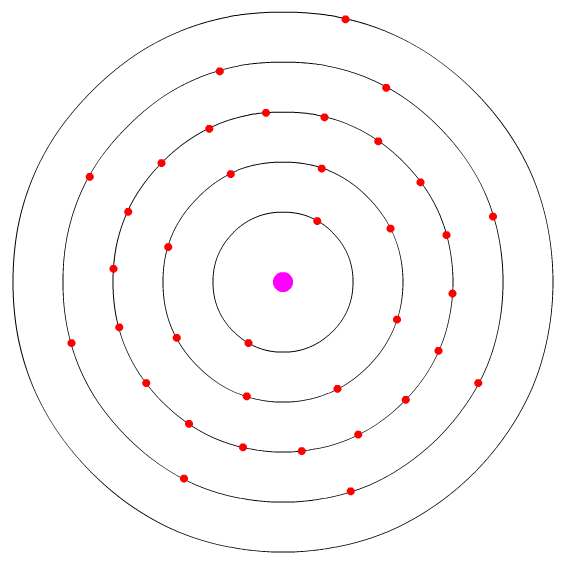
átomo de rubídio ilustrando o modelo de camadas - uma animação deste átomo pode ser vista no meu canal do YOUTUBE
Acima vemos um átomo de rubídio, localizado no primeiro grupo da tabela periódica, e portanto um metal alcalino. Seu número atômico é o 37, e portanto ele possui 37 elétrons (isto será explicado em detalhe abaixo).
Perceba que os elétrons se movem de maneira bastante organizada, divididos nas várias camadas.
Relação entre número de camadas de elétrons e posição na tabela periódica
As linhas horizontais da tabela periódica se chamam períodos , e as verticais se chamam grupos.
A primeira camada tem capacidade apenas para 2 elétrons, e é representada pelos elementos do primeiro período.
A segunda camada tem capacidade para 8 elétrons e é representada pelos elementos do segundo período. A camada completa-se no elemento Ne, que portanto possui sua segunda camada completa.
Se adicionarmos mais em elétron chegamos ao elemento Na, que possui um elétron apenas na sua terceira camada (abaixo):
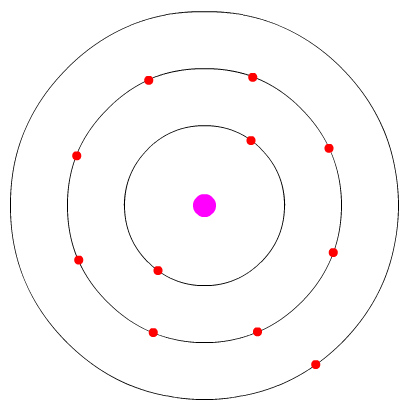
átomo de sódio (9 elétrons) ilustrando o modelo de camadas
Capacidade de cada camada
1:2
2: 8
3: 18
4: 32
5: 50
Pode-se encontrar a capacidade de cada camada pela fórmula 2n2
Embora os elétrons sejam muito pequenos para serem observados, existem muitas evidências de que eles se comportam desta maneira. Há inclusive uma experiência, o teste da chama, que é muito simples e ilustra o modelo de camadas do átomo. Foi também um tema da prova de química no ENEM 2017:
Vídeo: o teste da chama - uma experiência de física atômica ( no meu canal)
Número atômico
É o número de prótons no núcleo do átomo. Este número funciona como o RG do elemento, ou seja, sua identificação. Na tabela periódica os elementos estão ordenados de acordo com o seus número atômico. O número de nêutrons e de elétrons pode variar um pouco, em certos casos, mas se o número de prótons muda o elemento já não será mais o mesmo. O processo de transformar um elemento em outro se chama transmutação e era um dos objetivos principais dos alquimistas, que queriam transformar diversos metais em ouro, e estiveram tentando por muitos séculos. Hoje sabemos que isso é impossível porque a química lida apenas com elétrons. O ouro poderia ser produzido, a partir de outro elemento mais barato, em um laboratório de física nuclear, usando por exemplo aceleradores de partículas para inserir prótons no núcleo, mas apenas quantidades muito pequenas poderiam ser produzidas dessa forma, e o custo seria muitíssimo alto.
O átomo é eletricamente neutro, assim como a maior parte da matéria ao nosso redor também é. Conforme estudamos em física, cargas de mesmo sinal se atraem e cargas de sinais opostos se repelem. Estas forças elétricas são bastante intensas e por isso a matéria é geralmente neutra. Pense que a força elétrica é muito mais forte que a da gravidade. Se tudo estivesse carregado eletricamente seria um caos... Por exemplo, se tudo fosse negativamente carregado, o universo iria se desintegrar...
Portanto, o número de elétrons (negativos) e prótons (positivos) em um átomo tem que ser igual. Por isso que quando você está próximo a outra pessoa, você não sente forças elétricas de atração ou repulsão. Segundo calculado pelo Richard Feynman (grande físico e professor), se houvesse 1% mais eléctrons do que prótons, uma pessoa situada À distância de 1 metro de você, sentiria uma força imensa. Esta seria maior que o peso do Monte Everest! Seria igual ao peso do planeta inteiro!
Portanto se quisermos saber quantos elétrons tem num determinado átomo, basta saber o número atômico (pois o número de elétrons será igual.
Mas existem casos em que o átomo pode perder ou ganhar elétrons:
Íons
Em um processo químico, um átomo pode perder ou ganhar elétrons. Em ambos casos, ele se torna um íon, que pode ser positivo no caso da perda de elétrons ou negativo no caso de ganho.
Um elétron pode ser removido porque outro elemento chegou e o roubou (ver ligação iônica) ou porque o átomo recebeu energia na forma de luz ou calor. Ver o átomo excitado
Veja que a química estuda a penas os processos em que há troca de elétrons. Os nêutrons e prótons não participam da química. Uma reação que mexa com estes é uma reação nuclear, e envolve energias muito mais altas, como mencionado acima.
A força nuclear
Existem 4 forças na natureza: gravidade, eletromagnética, nuclear forte e nuclear fraca. Esta última é um pouco misteriosa e o único que se tem que saber é que ela está envolvida no decaimento beta (um tipo de radioatividade).
O núcleo se mantém unido devido à força nuclear forte, que como o nome diz é a mais forte da natureza (em segundo vem a eletromagnética). Esta força atua apenas entre as partículas do núcleo, e em mais nenhum outro lugar. Ela tem um raio de ação muito curto (diferentemente da gravidade que atua em distâncias galáticas) e por isso o tamanho do núcleo é também curto. A força de repulsão entre os prótons, por serem todos positivos. é gigantesca. Portanto a um conflito entre as duas maiores forças da natureza, em um espaço submicroscópico.
Os nêutrons não causam repulsão, porque não possuem carga elétrica, e então ajudam na coesão (união em um peça única) do núcleo, agindo contra a repulsão dos prótons. Os núcleos mais leves possuem o mesmo número de prótons e nêutrons, mas à medida que ele vai se tornando maior, mais nêutrons são necessários para manter o núcleo coeso. Por exemplo, o oxigênio tem 8 prótons e 8 nêutrons, enquanto o urânio tem 92 prótons e 146 nêutrons.
Número atômico, e número de massa
Numero de massa é a soma do número de prótons e nêutrons em um elemento. A massa dos elétrons não interessa porque eles são 2 mil vezes mais leves que os prótons e nêutrons, que tem a mesma massa.
Números de massa aparecem em algumas tabelas periódicas. Vamos ver alguns exemplos:
H - 1
O - 16
Cl - 35,45
Pergunta: Como que a soma dos número de prótons e nêutrons pode resultar num número fracionado, como no caso do cloro (35,45)?
Resposta: porque alguns elementos apresentam núcleos com diferentes números de nêutrons; estes se chamam isótopos .
Isótopos
São átomos de um mesmo elemento (mesmo número de prótons) mas com deferente número de nêutrons e portanto com massa diferente.
Perceba que quimicamente os isótopos são todos iguais e isso os torna muito úteis em pesquisas bioquímicas e médicas. Por exemplo, a comprovação que o DNA é o material genético, e não as proteínas, ocorreu com o uso de isótopos radioativos que eram parte destas moléculas estudadas. Um vírus com DNA contendo fósforo radioativo atacou uma bactéria, e este foi detectado dentro da mesma por meio de sua radioatividade. Da mesma forma se provou que a proteína, que forma a capa do vírus, não entrou una bactéria.
Assim mesmo, existem umas reações químicas seletas que podem discriminar isótopos, como por exemplo a fotossíntese. Plantas como o milho usam uma rota metabólica chamada C-4 enquanto a quase totalidade das outras plantas usa a rota C3 (formam-se moléculas de 3 carbonos ou 4).
Por isto uma análise isotópica pode acusar a presença de milho na cerveja, como aconteceu no estudo do CENA (centro de energia nuclear na agricultura) da faculdade de agronomia da USP em Piracicaba-SP. Link para artigo.
Esse teste é também muito usado para detectar a presença de milho no mel, o que é uma adulteração. No caso da cerveja acredito que também seja justo chamar de adulteração, apesar de a legislação não obrigar a listar todos os ingredientes no rótulo. Seria honesto informar.
Muitas vezes os isótopos são radioativos. Eles são muito importantes na medicina nuclear, por exemplo.
índice geral do curso de química >>
© Ricardo Esplugas de Oliveira, 2020
