Química > Básica > Misturas
Duas substâncias podem ser misturadas sem que haja reação química entre elas, de modo que não se forma uma nova substância e elas podem ser separadas se desejado.
O mapa conceitual abaixo resume as ideias principais. A ideia chave é que quando seu juntam substâncias, pode-se formar uma nova substância (caso haja reação química entre elas) ou não. Se não há reação química o resultado é apenas uma mistura.
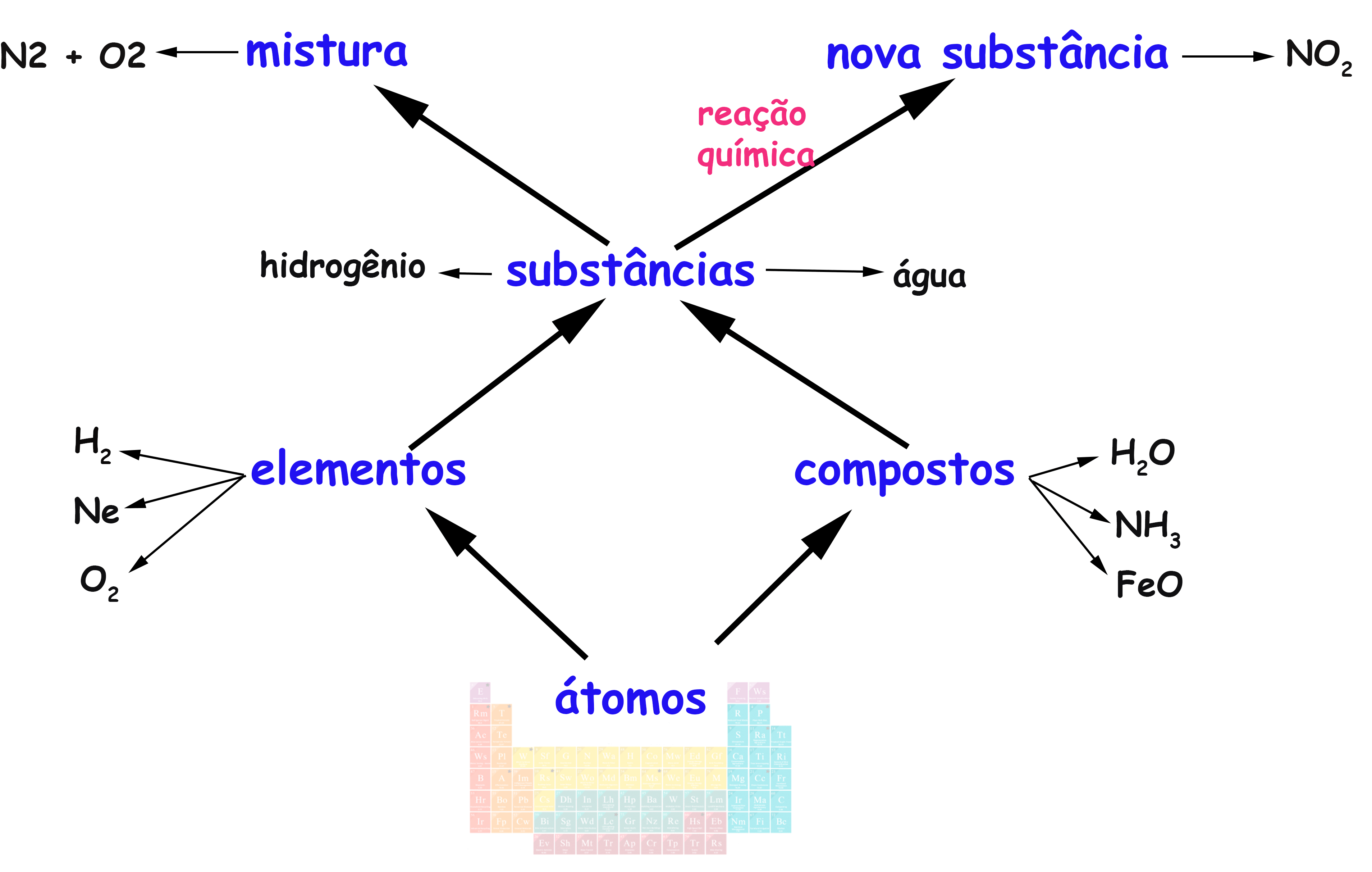
As substâncias que formam misturas podem ser separadas, pois seguem existindo separadamente, com suas próprias características químicas, que permitem a sua separação (separação de misturas). No caso da reação química, novas substâncias se formam e as anteriores deixam de existir. Há uma transformação química. A reação inversa, para recuperar as substâncias iniciais, pode ser possível ou não.
Uma substância sozinha (sem nada misturado) é chamada de substância pura.
Exemplo 1 - O ar é uma mistura
O ar que respiramos é composto de nitrogênio 78%, oxigênio 21% and argônio 0.9% . O 0.1% restante consiste de vários gases como de carbono , metano, ozônio, óxidos de nitrogênio e outros. A imagem abaixo ilustra os 3 gases mais abundantes, e é tirada da minhaanimação:
Animação: gases atmosféricos
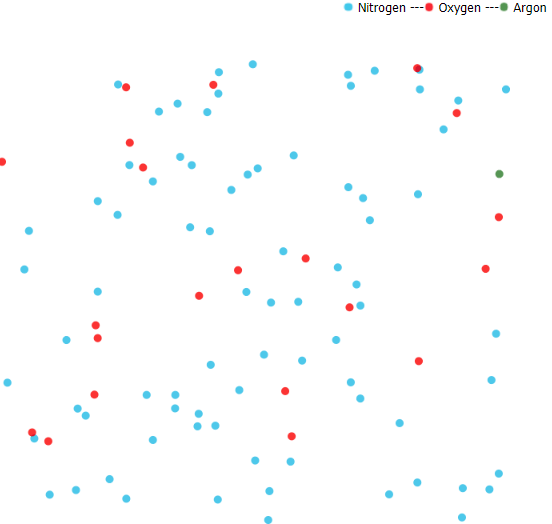
Imagem tirada da animação : gases atmosféricos
Cada um desses gases pode ser separado, usando meios que serão descritos abaixo.
Perceba que o oxigênio é capaz de "funcionar" como tal, mesmo estando em uma mistura. Ou seja, ele é capaz de sustentar combustão, como oxidante, estando isolado ou em uma mistura. Naturalmente que o oxigênio puro tem um efeito mais intenso
Exemplo 2 - formando uma nova substância
Se os dois maiores componentes da mistura chamada ar, oxigênio e nitrogênio, forem aquecidos a temperaturas elevadas (como acontece no interior de motores a diesel ou próximo a raios em tempestades) forma-se o NO (óxido de nitrogênio) que é uma nova substância. Nesse caso o oxigênio e nitrogênio deixam de existir separadamente porque se transformam em óxidos como NO, ou NO2 que aliás são poluentes da atmosfera.
O2 + N2 → 2 NO
Por isso a reversão desta reação é altamente desejável, mas não muito fácil. Ela ocorre no sistema de escapamento de caminhões contendo sistemas especiais para esse fim (apenas os mais recentes) , que consomem um a solução de ureia chamada ARLA. No entanto, o produto é nitrogênio e água e não nitrogênio e oxigênio, o que seria um processo ainda mais difícil.
Propriedades de substâncias puras e misturas
O conceito de substância pura é muito simples mas é muitas vezes mal entendido, devido aos seus usos não científicos que ocorre em anúncio publicitários , por exemplo. Um suco de laranja, por exemplo, não pode ser uma substância pura pois contém água, vitamina c e outras moléculas que conferem sabor e cor ao produto. Nem mesmo água mineral é pura, pois além de H2O contém minerais dissolvidos, como Ca, Fe, Li etc..Além disso ela possui também gases dissolvidos. Vejam portanto que é difícil obter uma substância pura. A sílica usada em fibras ópticas é um dos materiais mais puros que existem hoje.
Substâncias puras tem composições constantes, misturas não: Por exemplo, composição da atmosfera não é constante. A partir de altitudes de 100km , há uma diminuição na proporção de gases mais pesados (como o argônio) e um aumento dos mais leves, como hélio. Há também um aumento na proporção de ozônio, a famoso camada de ozônio nos protege dos raios UV e que é destruída por certos produtos feitos pelo homem.
Se eu quiser misturar açúcar na água, eu misturo na quantidade que quiser. Tem gente que gosta mais doce, tem gente que gosta do suco menos doce...
No caso da substância pura, a composição é constante. Por exemplo, água tem 2 átomos de hidrogênio para cada átomo de oxigênio (H2O). Isto não muda nunca, nem na Terra e nem no resto do Universo.
Substâncias puras tem pontos de fusão e ebulição bem definidos, misturas não.
A água tem ponto de fusão 0ºC e ponto de ebulição 100ºC (ao nível do mar). Estes são constantes. Da mesma forma, todas as substâncias puras tem estas propriedades químicas constantes.
Quando eu estava na graduação em química e sintetizava substâncias no laboratório, era de praxe checar o ponto de fusão do produto obtido (existe um aparelho exclusivamente para este fim, onde se introduz um tubo fino de vidro com a amostra) para confirmar que era o produto desejado. Antigamente não havia muitos métodos físicos para identificar moléculas ( como IV, UV ou ressonância magnética) e este teste era essencial.
No caso de misturas , as propriedades químicas dependem da proporção das substâncias misturadas. Por exemplo, o ponto de ebulição da água em uma panela depende de quanto sal ela contém; ele vai aumentar conforme aumenta a concentração de sal. O ponto de fusão da água também é alterado com o sal. Ele diminui.
Este efeito é explorado quando se coloca sal no gelo para que ele derreta. Isto é útil para descongelar as ruas congelam, e se tornam muito escorregadias. Cloreto de cálcio (mais barato que o cloreto de sódio) consumta ser espalhado sobre o gelo para este fim. O sal faz com que o gelo derreta porque seu ponto de fusão é abaixado. Ou seja, ele passa a congelar a uma temperatura mais baixa. O mesmo efeito é explorado para esfriar cerveja ou fazer sorvete. Quando adicionamos sal a uma mistura de água e gelo, o gelo derrete (pela razão explicada acima) e a temperatura da água diminui, pois o gelo retira calor da água para poder derreter.
Esses efeitos da quantidade de soluto nas propriedades químicas das soluções é estudado em físico-química, no capítulo propriedades coligativas.
Como explicado, as misturas podem ser separadas nas substâncias que a compõe usando-se diversas técnicas, explicadas no capítulo separação de misturas>>
Misturas homogêneas e heterogêneas
Estes conceitos são intuitivos, para que sabe o significado das palavras homogêneo e heterogêneo. MAis detalhes aqui em breve.
© Ricardo Esplugas de Oliveira, 2020
