Química > Básica > Eletronegatividade e moléculas polares
Eletronegatividade
Os elétrons são atraídos para o núcleo do átomo. Alguns átomos atraem os elétrons com mais intensidade, outros com menos. Essa propriedade se chama eletronegatividade, e é representada na tabela abaixo:
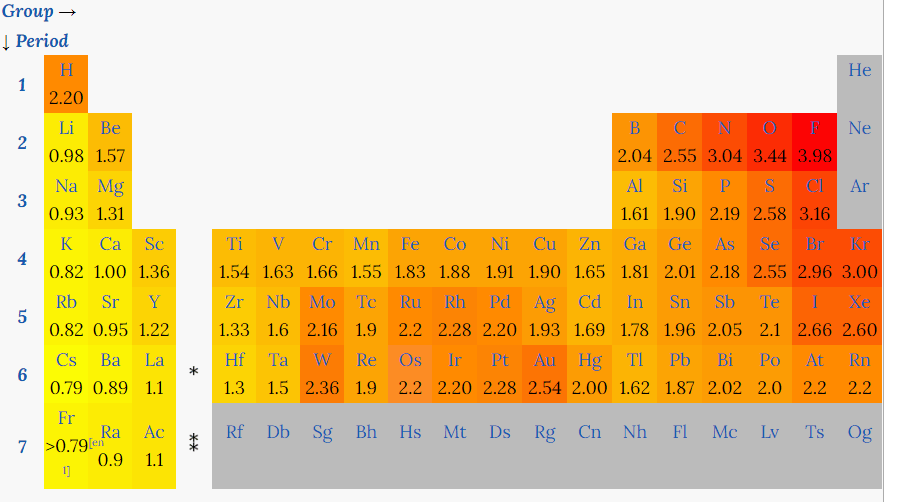
Tabela periódica mostrando tendencia em eletronegatividade e raio atômico
Percebe-se que a eletronegatividade aumenta na direção do vermelho mais forte, ou seja, da esquerda para a direita e de baixo para cima. O elemento mais eletronegativo é o flúor. Note também que os metais alcalinos (primeiro grupo) têm eletronegatividades muito baixas. Isso já era de se esperar pois eles possuem apenas um elétron na camada de valência, que pode ser facilmente perdido em alguma reação química.
Essa tendência de eletronegatividade observada na tabela é a mesma do raio atômico, ou seja, do tamanho do átomo. E é de se esperar que os menores átomos sejam os mais eletronegativos, pois os elétrons estão mais próximos do núcleo e portanto a força de atração (positivo atrai negativo) é mais intensa.
Moléculas polares
Em uma molécula diatômica , por exemplo, se um dos átomos for mais eletronegativo que o outro, a moléculas será polar.
Exemplo
Na molécula de H-Cl, o cloro é substancialmente mais eletronegativo que o hidrogênio. Os elétrons estarão mais próximos do cloro e portanto haverá uma caraga parcial negativa no cloro. Do lado do hidrogênio haverá falta de elétrons e portanto uma carga parcial positiva.
NA molécula de F-F ambos átomos de flúor são muito eletronegativos, mas como puxam igualmente os elétrons a molécula não é polar.
A carga total da molécula é zero e por isso chamamos de cargas parciais estas que se formam internamente na molécula, e que são representadas pela letra grega delta minuscula: δ. Ver exemplos no capítulo de forças intermoleculares>>
Propriedades de moléculas polares
Pontos de fusão e ebulição: As moléculas polares se atraem devido às cargas parciais e isso afeta os materiais que elas compões. Por exemplo eles tendem a ter pontos de fusão e ebulição mais altos do que materiais similares que são apolares. Isso é discutido em detalhes no capítulo teoria de partículas.
Densidade: Molécula polares formam substâncias mais densas, porque se atraem mais e então ficam mais próximas. Isto é explicado em detalhe aqui.
Hidrofóbico ou hidrofílico: A água é um exemplo de uma molécula polar, devido à ligação O-H. Outras moléculas polares apresentam afinidade pela água, devido às atrações causadas pelas cargas parciais. Portanto moléculas polares em geral são mais capazes de dissolver na água, ou seja, interagem mais intimamente com a água. Essa substâncias se chamam hidrofílicas (hidro-água, philos- gostar). Por outro lado, moléculas apolares não se misturam bem com a água e são chamadas de hidrofóbicas (hidro-água, phobos - não gostar). Água e óleo não se misturam por esta razão.
Exemplo:
A folha de inhame é um material hidrofóbico. Uma gota de água pode mover-se livremente por sua superfície (vídeo abaixo). Imagine o que aconteceria se essa gota fosse colocada sobre uma blusa de algodão? Seria absorvida imediatamente.
Outro exemplo:
Quando lavamos roupas notamos que aquelas feitas de tecido sintético (hidrofóbico) secam mais rápido que as feitas de algodão (hidrófilo).
Superfícies hidrofílicas e hidrofóbicas também atuam em outros sistemas essenciais à vida, além do DNA e proteínas como explicado acima. A membrana celular forma-se e organiza-se com base nestas interações. O seu funcionamento também depende disso. A membrana celular é formada de fosfolipídeos, que são moléculas anfipáticas (ou anfifílicas) , quer dizer, são polares e apolares ao mesmo tempo. Possuem uma extremidade polar (fosfato) e a outra apolar (lipídio). Ver aqui imagens de fosfolipídeos e de como eles compõe a membrana celular. Outros exemplos de moléculas anfipáticas são os detergentes.
Os lados apolares se juntam formando o centro da membrana, enquanto as partes polares ficam no exterior, interagindo com a água que é abundante na célula e seus arredores. É como um sanduíche de manteiga. A molécula de água por ser pequena consegue cruzar a membrana celular, com seu movimento através da membrana regulado por processos como osmose, mas moléculas polares maiores, como glicose, não cruzam a membrana porque são repelidas pela camada apolar (como vemos no meu vídeo da folha de inhame). Para atravessar elas dependem de estruturas especiais, como proteínas, que são integradas na membrana. Partículas carregadas , como íons, também não atravessam, nem mesmo H+. Veremos que a produção de ATP funciona com base no gradiente de H+ entre os dois lados da membrana tikaloide (dentro da mitocôndria)
Interações hidrofóbicas e hidrofílicas portanto agem na essência da vida, a membrana que forma todas as células de todos os seres vivos. A membrana possui proteínas de vários tipos, lipídeos e açúcares , todos integrados na sua estrutura,permitindo executar funções complexas. Pense que é a única organela que uma bactéria possui, e permite um comportamento - por exemplo o movimento na direção de onde há comida - que sugere a existência de um cérebro. Estas ideias são desenvolvidas por Bruce Lipman,em seu livro The Wisdom of Your Cells que considera a membrana como a coisa mais importante dos organismos vivos.
© Ricardo Esplugas de Oliveira, 2020
