Química > Básica > Soluções - Os químicos oferecem soluções!!
Adicionando açúcar (ou sal de cozinha) na água se produz uma solução!
INTRO
Solução é um tipo de mistura, onde geralmente um dos componentes é sólido e o outro líquido. No caso, sólido se dispersa de maneira microscópica de modo que não pode ser mais visto, portanto formando uma mistura homogênea. Por exemplo, em uma solução de açúcar em água, não vemos o açúcar, embora saibamos que ele está lá devido ao gosto doce da água. Neste caso o soluto e o açúcar e o solvente é a água. Outras propriedades do líquido também são alteradas, como as temperaturas de mudança de fase (líquida--> sólida por exemplo), como veremos em propriedades coligativas.
Além de sólidos , pode-se dissolver também gases ou outros líquidos.
Por exemplo:
o álcool 43% vendido nos mercados é uma solução de álcool em água. É homogênea porque não se veem os componentes separadamente. A cachaça também é uma solução de álcool em água.
Contraexemplo:
Uma mistura de areia e água não é homogênea pois se veem as duas fases separadamente: areia e água, ou seja, a areia não se dissolve na água. Este tipo de mistura chama-se heterogênea. A areia pode ser separada da água por filtração , mas o açúcar dissolvido na água não pode.
Soluções de gases em água, por exemplo, são também muito importantes. Perceba que se não existisse oxigênio dissolvido na água os peixes não poderiam respirar, e se não houvesse gás carbônico dissolvido na água o plâncton não poderia fazer fotossíntese. Aliás, a maior parte do oxigênio produzido no planeta provém da fotossíntese de organismos que vivem no mar ( e não de grandes florestas como muita gente pensa). Bebidas como refrigerantes e cerveja também possuem gás carbônico dissolvido, e portanto invisível; apenas quando a garrafa é aberta é que as bolhas de gás podem ser vistas, pois este sai do líquido devido à redução de pressão..
No caso mais geral, uma solução pode consistir de uma substância em qualquer dos 3 estados, dissolvida em outra que pode também estar em qualquer dos 3 estados, conforme ilustrado no mapa conceitual abaixo. Dessa forma, o soluto é definido como a substância em menor quantidade e o solvente a que está em maior quantidade:
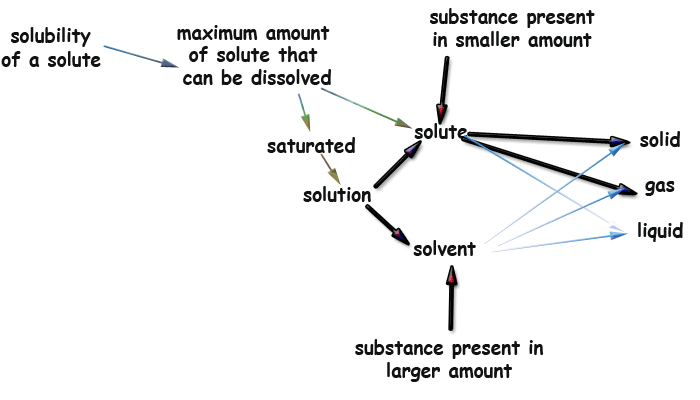
Mapa conceitual sobre soluções
Glossário do mapa conceitual:
maximum amount - quantidade máxima
dissolved - dissolvido
larger / smaller - maior / menor
Exemplos
gás em gás: a atmosfera. Pode-se dizer que o oxigênio (quase 20 %) está dissolvido no nitrogênio (80% da atmosfera). Se o oxigênio não estivesse dissolvido em nitrogênio, seria muito difícil a vida do planeta. Imagine que se houvesse 25% de oxigênio na atmosfera, a vegetação se incendiaria mesmo molhada!
gás em sólido: o hidrogênio pode ser dissolvido no metal paládio. Aliás , isto vem sendo testado como uma maneira de armazenar hidrogênio.
líquido em sólido: mercúrio (metal líquido) em ouro. O resultado chama-se amálgama. Este processo é usado para juntar ouro dispersado em pó ou pequenas pedras, e é um grande problema ambiental devido à toxicidade do mercúrio, especialmente na Amazônia.
sólido em sólido: uma liga metálica onde dois metais formam uma mistura homogênea, como no caso do bronze, que é uma liga de cobre e estanho.
Solubilidade
É a quantidade máxima de substância que pode ser dissolvida numa certa quantidade de solvente.
Por exemplo
a solubilidade do sal de cozinha (NaCl) em água é 360 g /l. Uma solução de 1 litro de água que contenha 360 g de NaCl é dita saturada. Se mais NaCl for adicionado a esta solução saturada, não haverá mais dissolução: o excesso será depositado no fundo do copo, na forma sólida. Às vezes se consegue dissolver um pouco além do ponto de saturação, e nesse caso a solução é dita supersaturada.
A solubilidade depende da temperatura. No caso de sólidos dissolvidos em líquidos, a solubilidade geralmente aumenta com o aumento da temperatura. No caso de gases o efeito é inverso, e por isso o aquecimento da água do mar causa uma redução na quantidade de oxigênio disponível para peixes, conforme discutido na seção de poluição térmica.
Perceba quando esquentando água para cozinhar macarrão, por exemplo, como o sal dissolve com facilidade. Se uma solução de NaCl aquecida saturada é deixada esfriar , o soluto (sal) passa a aparecer e eventualmente deposita-se no fundo do recipiente.
Este processo chama-se precipitação e será estudado em mais detalhe devido à sua importância. Precipitação é um termo técnico de química, mas que possui o mesmo significado usado na linguagem cotidiana, onde precipitar quer dizer cair. O substantivo precipício é formado a partir dessa ideia. A precipitação pode ser provocada por outros métodos, como a adição de outros reagentes.
A precipitação causada pela redução da temperatura (e consequentemente da solubilidade de determinada substância) é usada para se produzir cristais. Didaticamente, o mais comum é se produzir cristais de açúcar (link wikipédia), sulfato de cobre ou alúmen de potássio.
Concentração
É a quantidade de soluto num dado volume de solvente. Normalmente é dada em moles por litro, cujo símbolo é a letra M.
Exemplo
Se dissolvemos 1 mol de sal em 10 litros de água, a concentração será 1/10 M.
outros tópicos relacionados:
A imaginação nos estudos de ciência
