Química > Eletroquímica > Oxidação e redução
Reações de oxi-redução vão desde a queima e o enferrujamento até a bioquimica mais essencial da vida: a respiração
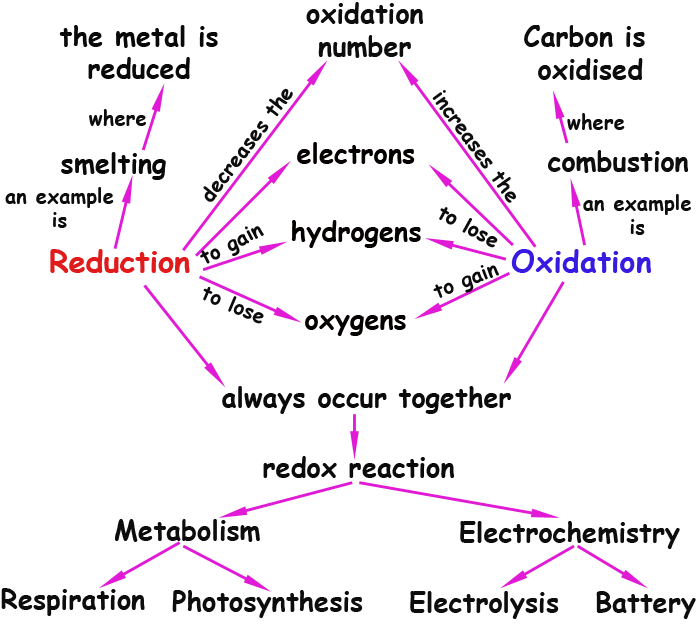
Glossário:
always occur together - sempre ocorrem juntos. Quer dizer, onde há oxidação há também redução,e vice-versa; um não ocorre sem o outro.
decrease / increase - aumenta / diminui
smelting - é o processo de extrair um metal do seu minério. Por exemplo, extrair o aluminio da bauxita (a rocha que contém o metal).
Os potenciais de eletrodo são também chamados de potenciais de redução, porque ser reduzido significa receber elétrons. Ser oxidado é o contrário, é perder elétrons.
Reações de oxidação e de redução são estudadas por toda a química, inclusive em química orgânica, que é a parte que mais cai em vestibulares.
Para que haja redução é necessário que haja oxidação ao mesmo tempo (se um ganha outro tem que perder) e por isso essas reações são chamadas de oxi-redução.
Os potenciais de eletrodo na dados na tebela são para redução, mas estas reações não poderiam ocorrer sozinhas sem a outra parte que é oxidada. Como aparece apenas a redução, na tabela, pode parecer que seja algo que ocorre assim isoladamente.
Número de oxidação
Um elemento que possui todos seus elétrons possui numero de oxidação 0. Este aumenta com a perda e diminui com o ganho de elétrons. Então por exemplo o Cu0 é muito diferente do Cu+2, pois o primeiro tem a forma macroscópica de metal avermelhado e o segundo está presente em soluções (na cor azul) ou em rochas, frequentemente de cores azul-esverdeado, como na rocha malaquita (abaixo), que é usada na fabricação de jóias.

Malaquita : uma minério de cobre que é usado como jóia e decoração
Aliás uma característica dos metais de transição é que els assumem diversas cores, dependendo do numero de oxidação. Por exemplo, soluções de vanádio com números de oxidação +2, +3 , +4 e +5 são vistos abaixo:

Estados de oxidação diferentes do vanádio (Foto da Wikipedia)
Reações
Na reação de oxi-redução, os números de oxidação de certos elementos e substâncias muda. Veja por exemplo:
MnO4 - (aq) + 8 H+ (aq) + 5e- --> Mn2+ (aq)+ 4 H2O (l); Eo = +1.51 V
O número de oxidação do Mn, em MnO4 - (aq) é +7 e , após a reação, em Mn2+ (aq) é +2, portanto diminuiu. O Mn sofreu oxidação, quer dizer, perdeu elétrons.
Perceba que no caso do íon, Mn2+ (aq), o número de oxidação já vem escrito. No caso de substâncias ele precisa ser calculado.
Como calcular números de oxidação de átomos em moléculas>>
A oxidação do ferro (enferrujamento) causa enormes despesas e problemas à humanidade. Neste caso:
4Fe + 3O2 →2 Fe2O3
O Nox do Fe antes da reação é 0 (estado fundamental), e depois é +3 . Ele perdeu elétrons e portanto foi oxidado.Vemos que ele ganhou oxigênios.
O Nox do oxigênio antes é 0 e depois é -2. Ele ganhou elétrons e portanto foi reduzido.
Uma palha de aço (bombril) é oxidada muito rapidamente , quando molhada.
A oxidação do ferro também pode produzir fogo (queima de bombril), como vemos em fogos de artifício que lançam pó de ferro para produzir lindas faíscas.
Alumínio- combustível de foguetes
A oxidação do alumínio é muito energética, ao ponto de ser usada em combustíveis de foguetes, como por exemplo no caso do ônibus espacial americano (space shuttle).
A reação termita, também baseada na oxidação do alumínio, é capaz de produzir temperaturas altíssimas, a ponto de derreter o ferro. Ela é usada para soldar trilhos de trem.
Termita:
Fe2O3 + 2 Al → 2 Fe + Al2O3
Perceba que o Al é mais reativo que o Fe e por isso pega o oxigênio.
O Nox do Fe antes da reação é +3, e depois é 0 (estado fundamental). Ele ganhou elétrons e portanto foi reduzido.Vemos que ele perdeu oxigênios.
O Nox do Al antes é 0 e depois é +3. O Al perdeu elétrons e portanto foi oxidado.Vemos também que ele ganhou oxigênios.
Exemplo da queima, uma reação orgânica
No caso de reações orgânicas, ser oxidado é ganhar oxigênios, e ser reduzido é perder oxigênios, ou ganhar hidrogênios, conforme o mapa no topo desta página . Normalmente estudamos reações de combustíveis com oxigênio, por exemplo:
© Ricardo Esplugas de Oliveira, 2020
