Química > Orgânica > Estrutura de Lewis e ressonância
Essas estruturas representam os elétrons de valência (os que valem para a química) e seus movimentos
ESTRUTURAS DE LEWIS
As estruturas de Lewis mostram detalhes das estruturas eletrônicas das moléculas e compostos, conforme explicado no capítulo de química básica. Elas mostram apenas os elétrons de valência, ou seja aqueles que estão na camada mais externa do átomo, pois são apenas estes que participam da química. Elétrons mais internos, assim como o núcleo, não participam de reações químicas.
Aqui estudaremos a aplicação das estruturas de Lewis na química orgânica, e em particular no conceito de ressonância.
Vemos abaixo como diferentes elementos completam seus 8 elétrons de valência:
O hidrogênio e os halogênios, F, Cl, Br , I, fazem apenas uma ligação. O e S fazem duas. N e P fazem 3. C e Si fazem 4.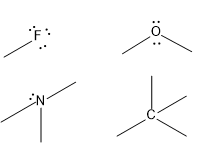
tendencias no número de ligações de elementos importantes em química orgânica
Cada ligação vale por 2 elétrons. O número de pares isolados de elétrons é maior nos elementos que fazem menos ligações.
Se o oxigênio fizer 3 ligações ele adquire uma carga positiva. O mesmo acontece com o nitrogênio se ele fizer 4 ligações como no caso do íon amônio: NH4+ .
RESSONÂNCIA
É um conceito muito importante na química e é derivado da mecânica quântica (MQ), a teoria da física moderna que estuda o comportamento de partículas muito pequenas, como os elétrons. Toda a química é determinada pelo que fazem os elétrons, e a QO não é diferente. As reações são o resultado do movimento dos elétrons, em direção a regiões de carga positiva, geralmente cargas parciais. Diversos mecanismos são mostrados nesse curso, onde as setas apontam para onde os elétrons vão:
A ressonância é o efeito de "deslocalização" dos elétrons em sistemas mais ricos em elétrons como aqueles contendo ligações duplas entre carbonos e entre carbono e oxigênio. Os elétrons não estão localizados apenas nas ligações representadas no papel, mas estão distribuídos em uma área muito maior. No caso do benzeno, por exemplo, os elétrons estão igualmente distribuídos ao longo do anel. Por isso ele é representado também com um círculo no centro:
representação de ressonância no benzeno
A ressonância no benzeno pode também ser representada com base nas ligações representadas na fórmula.. Este possui 3 ligações duplas e 3 ligações simples. A posição destas se alterna e isto é a ressonância.
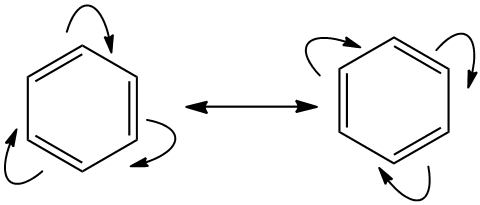
representação de ressonância no benzeno
As setas curvas indicam o movimento dos elétrons e portanto a alternância das ligações duplas. Setas curvas também servem para indicar o movimento dos elétrons de uma moléculas a outra em uma reação química. A seta reta, com duas pontas, simboliza a ressonância. Não confundir esta seta reta com o símbolo de equilíbrio químico que são duas setas , uma apontando em cada direção. A seta única reforça o fato de que trata-se da mesma molécula, dos dois lados, não há diferença. Neste caso há apenas duas formas de ressonância, mas dependendo da molécula podem haver mais.
O desenho acima, com o círculo, é mais realista porque no caso da ressonância as ligações não são simples ou duplas, apenas. Acontece algo intermediário.
Em compostos que não apresentam ressonância, as ligações duplas são mais fortes que as simples, porque há mais elétrons presentes. Por isso elas são mais curtas que as ligações simples, onde os átomos ficam um pouco mais afastados. No caso do benzeno, a distância entre os átomos de carbono no anel é maior do que das ligações simples e menor do que das ligações duplas, portanto algo intermediário.
Compostos como o benzeno que apresentam ressonância em anéis se chamam aromáticos. Essa ressonância do benzeno pode estender-se por diversos anéis (compostos poliaromáticos).
energia de ressonância do benzeno>>
A naftalina consiste de 2 anéis de benzeno que se fundem, mantendo a aromaticidade. Mas muitos mais anéis podem se fundir, como por exemplo no caso do hexabenzocoroneno:
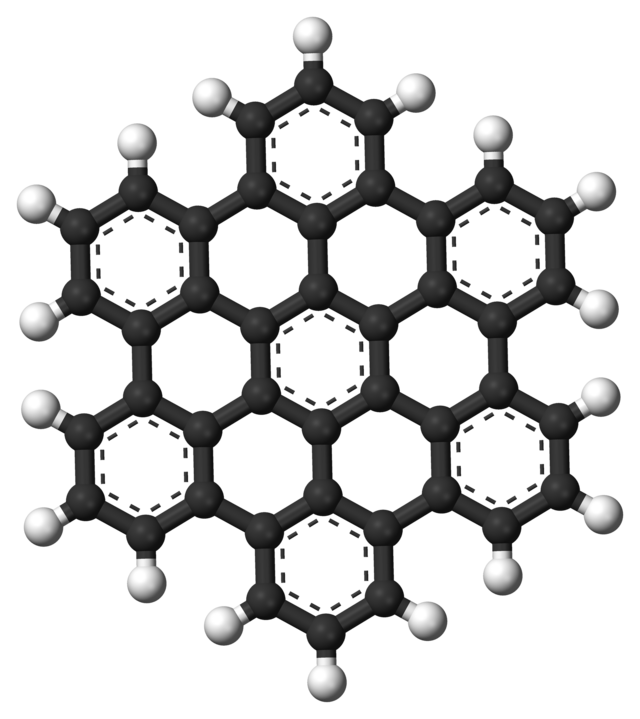
Estruturas aromáticas similares, muito maiores que essas também podem ser construídas, como no caso do grafite e dos fulerenos e nanotubos, que são os materiais do futuro. Nanotubos são, por peso, muitíssimo mais fortes do que aço ou qualquer outro material existente. O problema é que atualmente só se consegue fazer nanotubos com alguns centímetros de comprimento, apenas. Este material seria essencial para projetos revolucionários como, por exemplo, o elevador espacial, que necessita muitos kilometros de cabo para subir da superfície da Terra até o espaço, e evitar os foguetes que são muito caros, especialmente para levar cargas em órbita.
Curioso pensar que temos tantas estruturas importantes baseadas no hexágono aromático , o que lembra aquele arame para galinheiros (chicken wire). O grafite é feito de imensas camadas de hexágonos. Uma simples camada é o grafeno.
Contraexemplo de ressonância:
O ciclooctatetraeno possui ligações duplas alternadas mas não é aromático. A quantidade de elétrons não é adequada. E além disso ele não é plano, para facilitar a circulação dos elétrons:
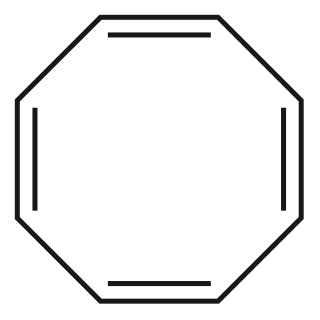
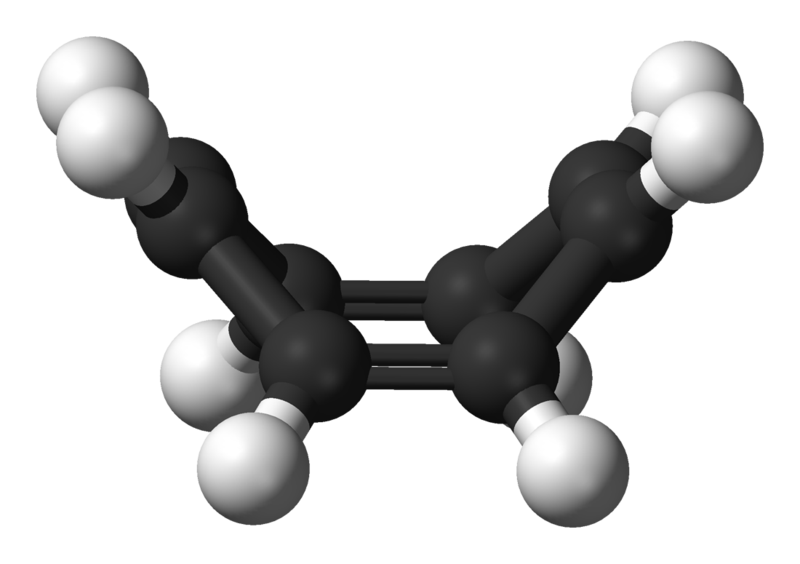
Imagens do ciclooctatetraeno: acima fórmula esquelética e abaixo modelo ball-stick mostrando que a molécula não é plana (Imagens da Wikipedia)
Ainda mais curioso é o fato de que o ciclooctatetraeno que perde 2 elétrons é aromático:
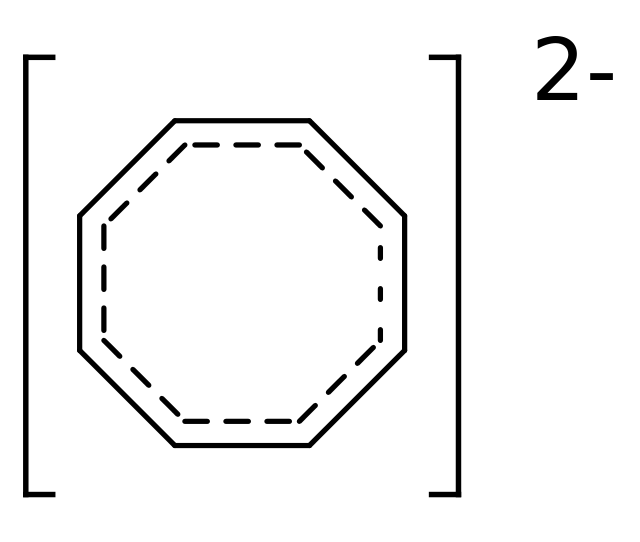
Ciclooctatetraeneto : Imagem da Wikipedia
Mas a ressonância não ocorre apenas em anéis de carbono. Outro exemplo importante de ressonância é o íon nitrato. Ele possui uma ligação dupla e duas triplas. Mas como escolher a posição da ligação dupla? Ela pode estar em qualquer posição. De fato , trata-se de uma ressonância e a distância da ligação química entre N e O é nesse caso é intermediária entre a simples e a dupla, para os três oxigênios.

ressonância do íon nitrato
Usando a estrutura de Lewis, as ressonâncias do nitrato ficariam assim:
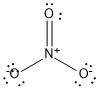
ressonância do íon nitrato com estruturas de Lewis
Perceba que o oxigênio adquire 1 carga negativa no caso de 2 ligações e 3 pares isolados.
Outros exemplos de ressonâncias:
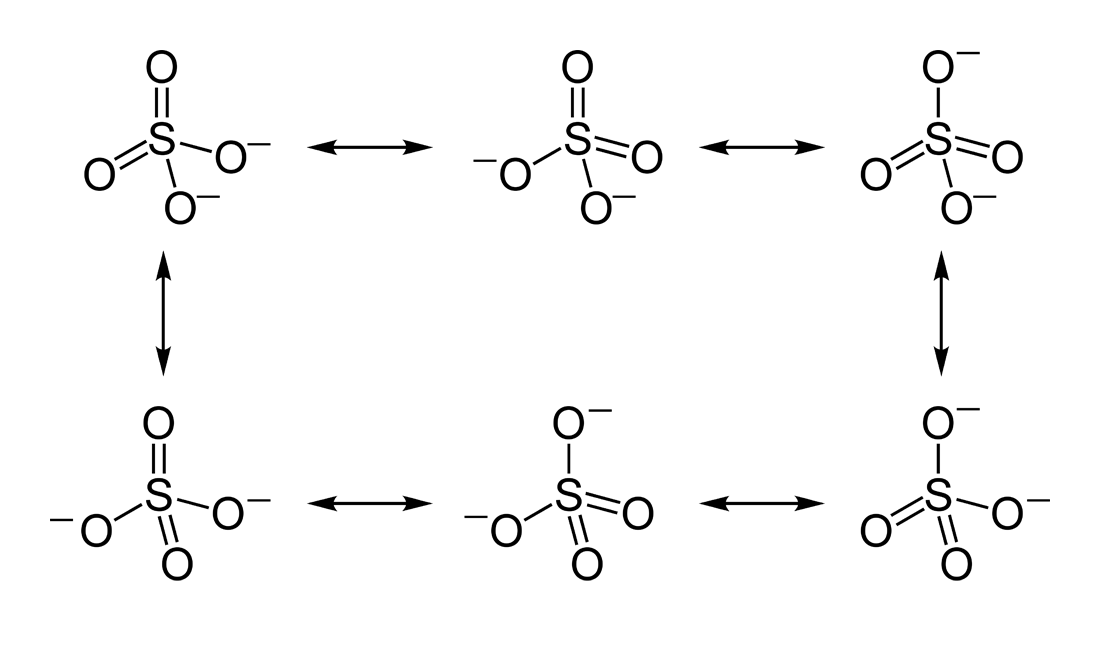
ressonâncias do íon sulfato
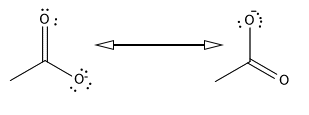
ressonâncias do íon acetato
Ressonância e estabilidade
Ressonância é muito importante porque confere uma estabilidade extra à molécula. Uma molécula estável é menos reativa, ou seja, ela quer ficar como está, com seus elétrons desfrutando da liberdade extra.
Isto pode parecer estranho e é estranho mesmo. É uma consequência das leis da mecânica quântica, que representam um física diferente da que estamos acostumados por nossas experiências cotidianas.
A presença de elétrons deslocalizados (e portanto ressonância) em um anel (estrutura cíclica de carbonos) chama-se aromaticidade. O benzeno é uma substância tóxica, mas organismos vivos possuem moléculas aromáticas como por exemplo bases que formam parte das estruturas do DNA e do RNA.
Ressonâncias estão presentes em diversas moléculas orgânicas.
A ressonância aumenta a estabilidade à molécula, ou seja, fica mais difícil de quebrá-la. Em outras palavras, a reatividade da molécula diminui. Isto pode ser uma boa coisa, por exemplo na moléculas de DNA (ou RNA) onde estabilidade é muito importante para que a informação genética esteja seguro e protegida ao longo dos bilhões de anos de existência da vida neste planeta. Alterações no DNA em organismos vivos pode causar câncer, embora muitas vezes a própria célula pode fazer o reparo por meio de enzimas especializadas.
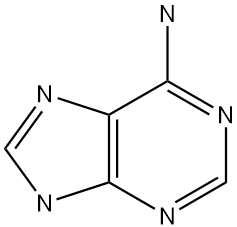
A base adenina , que integra o DNA e o RNA. Notam-se ligações duplas conjugadas (alternadas) como no caso do benzeno.
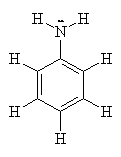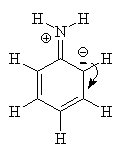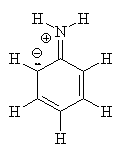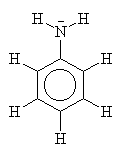
animação de ressonâncias da anilina
© Ricardo Esplugas de Oliveira, 2020
