Química > Orgânica > Isomerismo > Isomeria óptica - moléculas quirais
Isomeros são moléculas que tem a mesma fórmula molecular, mas diferentes fórmulas estruturais. Isômeros ópticos conseguem rodar a polarização da luz, e são muito difíceis de separar
ISOMERIA ESPACIAL: Isomeria óptica
Neste tipo de isomeria espacial, um isômero é a imagem de espelho do outro. É o mesmo que occore com as mãos: uma é a imagem de espelho da outra, o que significa que não são idênticas: um par de luvas consiste de peças diferentes. Por isso o nome chiralidade, pois em grego chiros quer dizer mão.
É um tipo de geometria espacial e portanto é necessário usar a inteligência espacial. Vejamos exemplos:
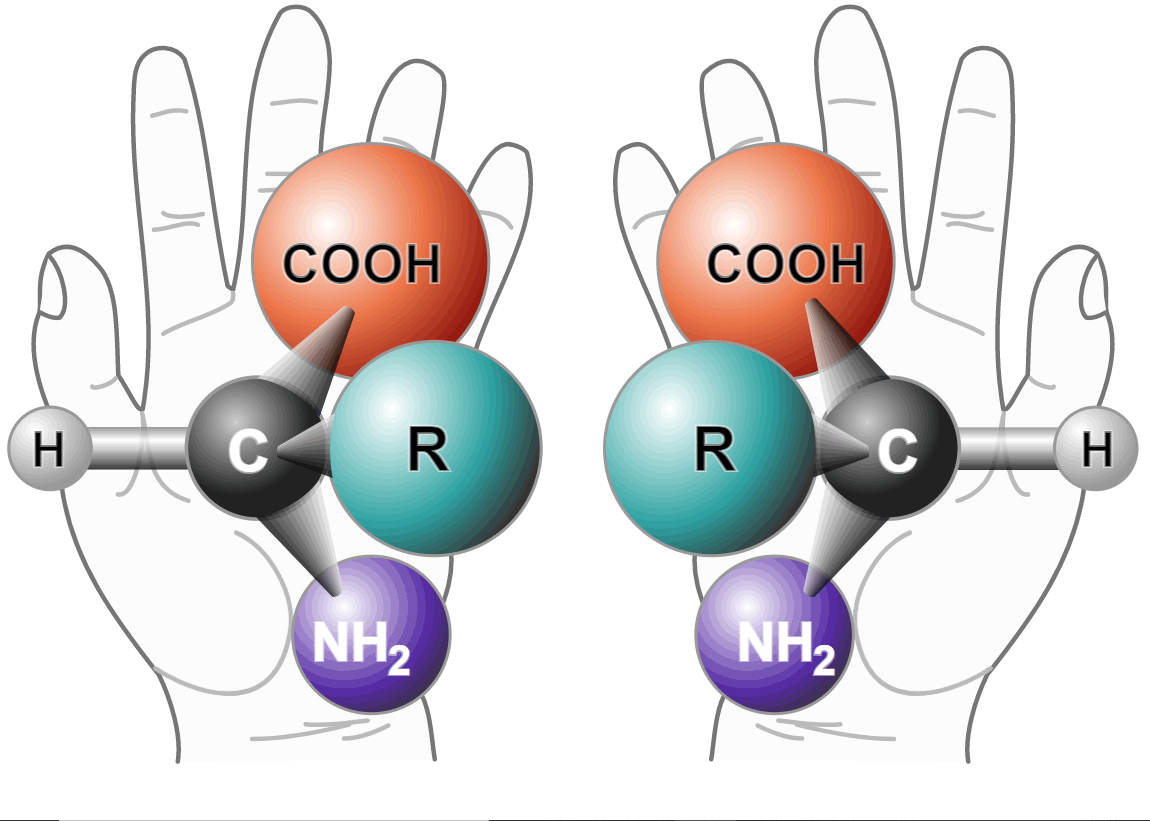
Veja que o carbono está ligado a 4 grupos diferentes (o grupo R- pode ser uma cadeia de carbonos e tal...). e é chamado de carbono assimétrico. Uma molecula pode ter diversos carbonos assimétricos. Há questões de vestibular que pedem para identificar carbonos assimétricos.
Por que isomeria óptica?
Porque as moléculas que apresentam esta isomeria (por possuírem carbono assimétrico) giram o plano de polarização da luz. Existe um tipo especial de luz, chamdo luz polarizada (como o laser por exemplo), em que a luz se propaga em um plano apenas.
A polarização da luz é explorada em fotografia , por exemplo, onde se poder usar um filtro que seleciona luz de um certo plano de polarização, o que é útil para eliminar a luz refletida no mar , por exemplo, porque esta é polarizada em outra direção. Se você superpõe 2 filtros destes, a um ângulo de 90 graus, toda a luz é barrada pelos filtros, conforme demonstrado neste vídeo.
Cada substância, que apresenta isomeria óptica, possui um grau de rotação típico. Este pode ser medido por um instrumento chamado polarímetro, que mede o quanto o plano da luz é girado, após atravessar a substância estudada, geralmente em solução.
O açúcar invertido
Quem lê os detalhes nos rótulos dos alimentos com frequência vê este ingrediente. É um açúcar mais conveniente para a indústria, pois com ele os alimentos duram mais e tal. Invertido, como você pode ter já advinhado, é relativo à rotação do plano da luz. Vejamos a rotação causada pela sacarose, e seus componentes glicose e frutose:
| Sugar | [α] (°) |
|---|---|
| Sucrose | +66.5 |
| Glucose | +52.7 |
| Fructose | −92.0 |
Dados: wikipedia
A sacarose (dissacarídio) pode ser hidrolisada (quebrada em reação com a água) liberando seus dois componentes, glicose e frutose, formando o açúcar invertido. O direção do plano de polarização da luz é invertida. Vemos na tabela que a sucrose gira o plano de 66,5 graus na direção positiva. A glicose também gira na direção positiva mas a frutose gira na direção negativa, e de uma ângulo maior: 92 graus. Portanto a luz que atravessa a solução de açúcar invertido sairá girada para a esquerda, ao contrário do que acontecia na solução de sacarose , quando ela saía girada para a direita.
Aminoacidos : L e D
Dos aminoácidos que formam as nossas proteínas , apenas um não apresenta carbono assimétrico (e portanto isomeria óptica), que é a glicina. Abaixo o aminoácido alanina, com seu carbono assimétrico indicado pela seta:
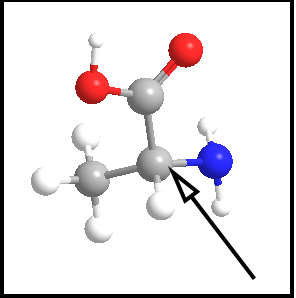
aminoácido alanina
Notem que a molécula da alanina possui um grupo funcional ácido carboxílico (com oxigênios em vermelho) e um grupo amina (com nitrogênio em azul). O carbono indicado faz ligações com 4 grupos diferentes e portanto é assimétrico, e a alanina tem isômeros ópticos.
Os isômeros que giram o plano da luz para a esquerda são classificados como L, e os que giram para a direita por D.
É interessante notar que todos os 19 aminoácidos quirais estão presentes em nossas proteínas apenas na forma L !
Muitas vezes não se detecta a rotação da luz em uma solução, onde ambos isômeros ópticos estão presentes (L e D) porque cada isômero roda a luz pro lado oposto, com o mesmo ângulo e portanto o efeito total é nulo.
Além disso, é difícil separar isômeros ópticos, porque as características químicas são muito semelhantes , por isso ambos isômeros podem ser vendidos para uma determinada aplicação.
A tragédia da talidomida
Mas um caso extremo obrigou a indústria farmacêutica a tratar com cuidado esta questão da mistura dos isômeros ópticos.
A talidomida era vendida sem separação dos isômeros ópticos , e o que não se sabia na época era que o isômero L era eficaz mas o D era altamente tóxico. Era comum que lulheres grávidas tomassem esta droga, o que causava defeitos no bebê, cuja gravidade dependia da idade do feto quando da presença da droga. Dez a vinte mil crianças nascerasm com defeitos, os quais podiam ser muto graves.
© Ricardo Esplugas de Oliveira, 2020
