QUESTÕES DE VESTIBULAR > FUVEST > Química - Equilíbrio
1 - (2003) Em uma experiência, aqueceu-se, a uma determinada temperatura, uma mistura de 0,40 mol de dióxido de enxofre e 0,20 mol de oxigênio, contidos em um recipiente de 1L e na presença de um catalisador. A equação química, representando a reação reversível que ocorre entre esses dois reagentes gasosos, é 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g). As concentrações dos reagentes e do produto foram determinadas em vários tempos, após o início da reação, obtendo-se o gráfico:
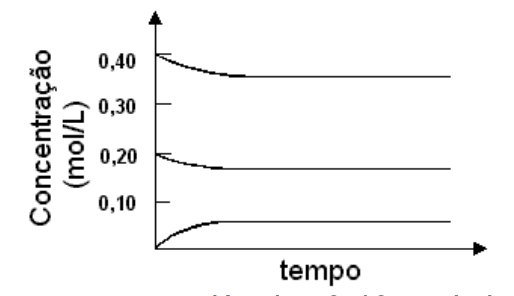
Em uma nova experiência, 0,40 mol de trióxido de enxofre, contido em um recipiente de 1L, foi aquecido à mesma temperatura da experiência anterior e na presença do mesmo catalisador. Acompanhando-se a reação ao longo do tempo, deve-se ter, ao atingir o equilíbrio, uma concentração de SO3 de aproximadamente
a) 0,05 mol/L b) 0,18 mol/L c) 0,20 mol/L d) 0,35 mol/L e) 0,40 mol/L
2 - (2005) O Brasil produz, anualmente, cerca de 6 x 106 toneladas de ácido sulfúrico pelo processo de contacto. Em uma das etapas do processo há, em fase gasosa, o equilíbrio 2 SO2 (g) + O2 (g)⇌ 2 SO3 (g) , KP = 4,0 x 104 que se estabelece à pressão total de P atm e temperatura constante.
Nessa temperatura, para que o valor da relação x2 SO3 / x2 SO2 x2 O2 seja igual a 6,0 x 104 , o valor de P deve ser
a) 1,5 b) 3,0 c) 15 d) 30 e) 50
x = fração em quantidade de matéria (fração molar) de cada constituinte na mistura gasosa
KP = constante de equilíbrio
3 - (2000) Considere o equilíbrio, em fase gasosa,
CO(g) + H2O(g)⇌CO2(g) + H2(g)
cuja constante K, à temperatura de 430 ºC, é igual a 4. Em um frasco de 1,0 L, mantido a 430ºC, foram misturados 1,0 mol de CO, 1,0 mol de H2O, 3,0 mol de CO2 e 3,0 mol de H2 . Esperou-se até o equilíbrio ser atingido.
a) Em qual sentido, no de formar mais CO ou de consumi-lo, a rapidez da reação é maior, até se igualar no equilíbrio? Justifique.
b) Calcule as concentrações de equilíbrio de cada uma das espécies envolvidas (Lembrete: 4 = 2 2 ).
Observação: Considerou-se que todos os gases envolvidos têm comportamento de gás ideal.
4 - (2003) Cobalto pode ser obtido a partir de seu óxido, por redução com hidrogênio ou com monóxido de carbono. São dadas as equações representativas dos equilíbrios e suas respectivas constantes a 550°C.
I. CoO(s) + H2(g) ⇌Co(s) + H2O(g) K1 = 67
II. CoO(s) + CO(g) ⇌ Co(s) + CO2(g) K2 = 490
a) Mostre como se pode obter a constante (K3) do equilíbrio representado por CO(g) + H2O(g) ⇌ CO2(g) + H2(g) a 550°C, a partir das constantes dos equilíbrios I e II.
b) Um dos processos industriais de obtenção de hidrogênio está representado no item a. A 550°C, a reação, no sentido da formação de hidrogênio, é exotérmica. Para este processo, discuta a influência de cada um dos seguintes fatores: – aumento de temperatura. – uso de catalisador. – variação da pressão.
Questões da FUVEST em outros tópicos>>
