QUESTÕES DE VESTIBULAR > FUVEST > Química - termoquímica -respostas
(FUVEST-2000) Com base nos dados da tabela,
| Ligação | Ligação Energia de ligação (kJ/mol) |
| H-H | 436 |
| Cl-Cl | 243 |
| H-Cl | 432 |
pode-se estimar que o ΔH da reação representada por
H2(g) + Cl2(g) → 2HCl(g) dado em kJ por mol de HCl(g), é igual a:
a) –92,5 b) –185 c) –247 d) +185 e) +92,5
Resposta:
Calculamos as energias para formar e quebrar aa ligações químicas nesta reação (conforme explicado aqui):
Input (energia consumida para quebrar ligações)
H-H + Cl-Cl = 436+243 = 679
Output (energia liberada pela formação de ligações)
2 H-Cl = 2* 432 = 864
Nota-se que mais energia é liberada que consumida e portanto a reação é endotérmica e por isso ΔH é negativo.
The calculation shows that more energy is released than is needed to initiate the reaction. That means that the reaction is exothermic and so ΔH is negative.
O cálculo é simplesmnete 679-864 = -185 kJ
Agora vem a pegadinha:
Esse é o valor para formar 2 HCl (2 moles). A pergunta é sobre kJ por mol , então trata-se de apenas 1 mol, e portanto dividimos -185 por 2:
Resposta:
a) –92.5
(FUVEST-2007) A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico. Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo Na+ (aq) e Cl- (aq) .
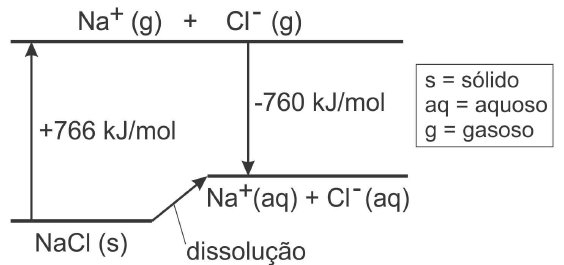
Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal
a) é acentuadamente exotérmica, envolvendo cerca de 103 kJ.
b) é acentuadamente endotérmica, envolvendo cerca de 103 kJ.
c) ocorre sem troca de calor.
d) é pouco exotérmica, envolvendo menos de 10 kJ.
e) é pouco endotérmica, envolvendo menos de 10 kJ.
Resposta:
Perceba que (aq) é aquoso, quer dizer dissolvido na água, (s) é sólido e (g) gás.
Para transformar o sal de cozinho em gás, com seus íons separados, é necessário colocar energia, obviamente é necessário esquentar o sol. Portanto o processo é endotérmico. 766 kJ/mol de energia são necessártios para que isto ocorra.
Já o processo de transformar estes íons gasos em aquosos (dissolvidos em água) a seta aponta na direçaõ oposta e portanto o processo é exotérmico.
Dadas as energias destes 2 processos, pode-se calcular a energia de outro processo, segundo o diagrama, que é a passagem do estado (s) para o (aq).
Esta seta aponta para cima e portanto o processo é endotérmico. O valor da energia consumida é 766 - 760 = 6 kJ/mol. Este cálculo é explicado em mais detalhes na seção de Lei de Hess.
O resultado é que a água ficará mais fria após a dissolução do sal.
Portanto a resposta é:
e)
(FUVEST-2010) O “besouro bombardeiro” espanta seus predadores, expelindo uma solução quente. Quando ameaçado, em seu organismo ocorre a mistura de soluções aquosas de hidroquinona, peróxido de hidrogênio e enzimas, que promovem uma reação exotérmica, representada por:
C6H4(OH)2(aq) + H2O2(aq) → C6H4O2(aq) + 2 H2O(l)
O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔH = +177 kJ . mol-1
H2O(l) + ½ O2(g) → H2O2(aq) ΔH = +95 kJ . mol-1
H2O(l) → ½ O2(g) + H2(g) ΔH = +286 kJ . mol-1
Assim sendo, o calor envolvido na reação que ocorre no organismo do besouro é
a) -558 kJ.mol-1
b) -204 kJ.mol-1
c) +177 kJ.mol-1
d) +558 kJ.mol-1
e) +585 kJ.mol
Resposta:
Este é mais um exemplo de uso da Lei de Hess. onde os termos na equação química são manipulados como em álgebra.
É resolvido por tentativa e erro. Deve-se tentar diferentes maneira de combinar as reações dadas, cujas entalpias são conhecidas, para se obter a equação desejada e consequentemente sua entalpia.
Este resultado é alcançado se invertemos as reações 2) e 3) e depois adicionamos elas à reação 1). Portanto o total é 177 - 95 - 286 = -204.
b) -204 kJ mol-1
