Química > Físico-química > Entalpia > Cálculo de entalpia
Utilize a minha calculador de entalpia de combustão>>
Existem 3 maneiras principais de se calcular entalpia de reação, com base :
1) nas entalpias de cada ligação química a ser feita e quebrada (explicado abaixo)
3) nas entalpias de formação de reagentes e produtos
Os dois últimos métodos são mais precisos do que o primeiro, que depende de valores de entalpias de ligação que variam um pouco dependendo da molécula.
1) Entalpia de reação baseado nas entalpias de ligação química
A formação de reações químicas é um processo que libera energia. Quanto maior a entalpia das ligações formadas, maior a energia liberada. Isto parece um pouco estranho para certas pessoas, mas pode ser melhor compreendido se se imagina o processo oposto: a quebra das ligações. É bastante intuitivo que para quebrar algos seja necessário energia. No caso da reação química isso é exatamente o que acontece. Portanto a formação da ligação deve liberar energia.
Mostro abaixo exemplos destes cálculos. Uma calculadora baseada nas ligações quebradas e formadas de reações de combustão pode ser utilizada aqui.
O símbolo da entalpia é o H. Para a entalpia de reação usa-se ΔH. A letra grega Δ (delta) é usada para representar variações (há vários usos da delta em física também).
Exemplo 1) um cálculo de entalpia de combustão: a combustão do metano
CH4 + 2 O2 --> CO2 + 2 H2O
Ligações quebradas:
4 C-H + 2 O=O
4*414 + 2*498 = 2652 (energia que deve ser fornecida é positiva)
Ligações formadas:
2 C-O + 4 H-O
-2*800 -4*470 = -3480 (energia liberada é negativa - entenda o porquê disso)
A entalpia da reação é a diferença entre os 2 valores => ΔH = 2652 - 3480 = - 828 kJ/mol
O sinal negativo do resultado significa que a reação é exotérmica, ou seja, libera energia na forma de calor. Isto era esperado neste caso pois a energia liberada é maior que a energia fornecida.
Este exemplo pode ser usado na minha calculadora de entalpia de combustão, para se obter o resultado diretamente.
Um cálculo mais preciso , baseado na Lei de Hess, chega ao resultado: ΔH = -891 kJ/mol.
Exemplo 2) um cálculo de entalpia de combustão: glicose
A equação desta reação é dada abaixo.
C6H12O6 + 6 O2 --> 6 CO2 + 6 H2O
Para se saber quais ligações são quebradas é preciso conhecer a fórmula estrutural, mostrada abaixo(oxigênio-vermelho, carbono-preto, hidrogênio-rosado).
O cálculo pode ser feito manualmente e depois checado na calculadora de entalpia de combustão.
-Image-good-300.gif)
estrutura ball and stick da glicose
Resposta: -2800 kJ/mol
Este resultado é muito próximo do valor experimental de -2805.0 ± 1.3 (referencia: http://webbook.nist.gov/cgi/cbook.cgi?ID=C492626&Mask=2 )
Exemplo 3)um cálculo de entalpia de combustão: TNT
A equação da reação de TNT com oxigênio é:
C7H2(NO2)3CH3 + 6.25 O2 --> 8 CO2 + 2.5 H2O + 1.5 N2
Para que se possa ver quais ligações devem ser quebradas, a fórmula estrutural é apresentada :
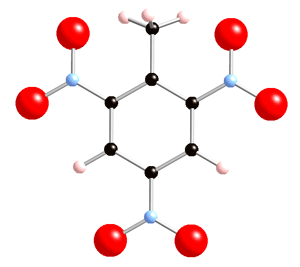
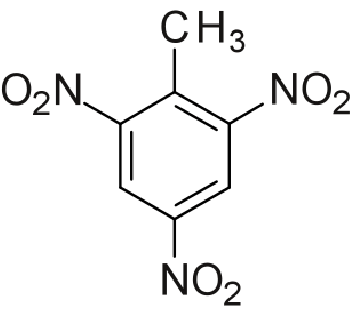
Fórmula estruturais do TNT: balls and stick (acima) e esqueletal (abaixo)
Ligações quebradas:
Perceba que o NO2 apresenta ressonância (revisar ressonÂncia):
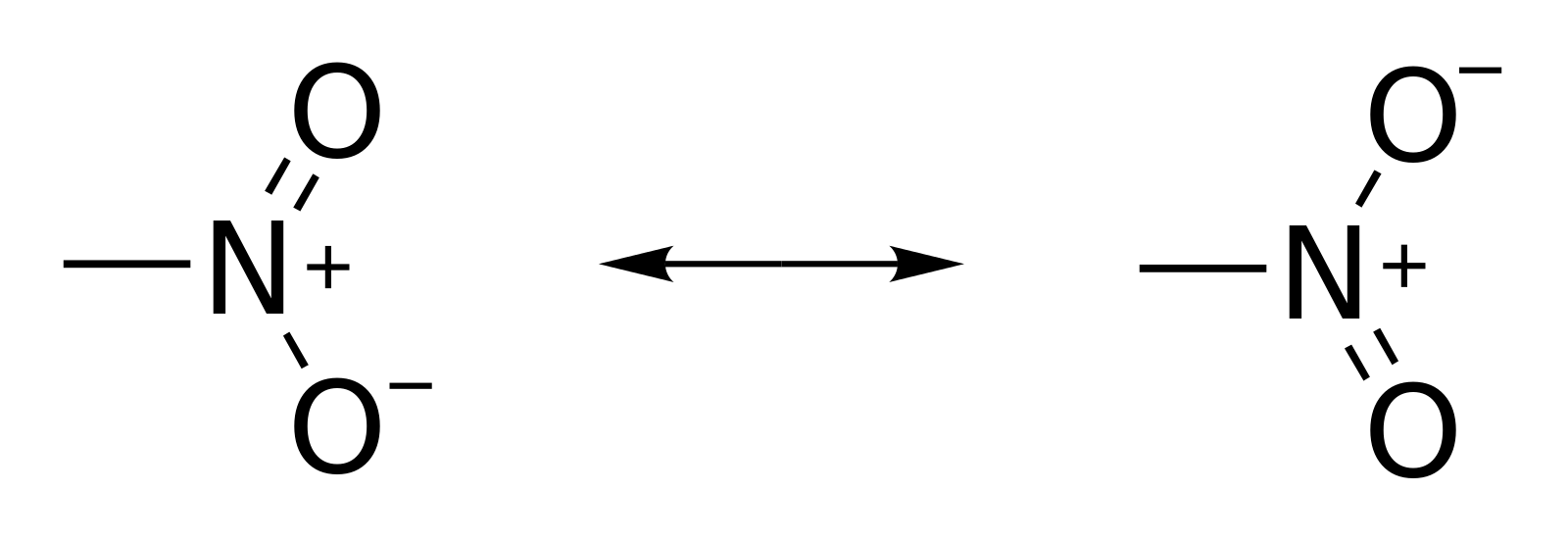
Portanto podemos calcular como se houvesse uma ligação simples e uma dupla (embora na prática o que existe são duas ligações de caráter intermediária entre simples e dupla, conforme explicado aqui):
| grupo | quantidade |
| N-O | 1 |
| N=O | 1 |
Para cada grupo NO2 há também uma ligação C-N, que é a ligação com o anel .
O total para os 3 grupos nitro é:
| grupo | quantidade |
| N-O | 3 |
| N=O | 3 |
| C-N | 3 |
No anel aromático também há ressonância. Podemos considerar isso como:
| grupo | quantidade |
| C-C | 3 |
| C=C | 3 |
O grupo CH3 apresenta:
| grupo | quantidade |
| C-H | 3 |
e mais uma ligação C-C que é a ligação ao anel.
Ligações formadas:
16 C=O, 5 O-H e 1.5 N ≡ N (de acordo com a equação fornecida acima)
Agora podemos inserir esses números na calculadora de entalpia, para obter o resultado!
Perceba também , pela fórmula, que além da grande quantidade de energia liberada, muitos moles de gases são produzidos, o que contribui para o impacto (blast) da explosão.
Média de entalpias de ligação química
(kJ/mol)
Ligações simples
| N-N | 161 |
| O-O | 139 |
| O-H | 470 |
| H-H | 435 |
| C-H | 414 |
| N-H | 389 |
| S-H | 339 |
| C-O | 352 |
| C-C | 348 |
| P-O | 419 |
| N-O | 222 |
| S-H | 339 |
| C-N | 293 |
| C-S | 260 |
| S-S | 214 |
| Si-O | 369 |
Ligações duplas
| C=S | 477 |
| O=O | 498 |
| C=O | 800 |
| C=C | 615 |
| N=N | 418 |
C=N |
615 |
| N=O | 607 |
Ligaçoes triplas
| C ≡ C | 812 |
| N ≡ N | 946 |
| C ≡ N | 890 |
© Ricardo Esplugas de Oliveira, 2020
