QUESTÕES DE VESTIBULAR > FUVEST > Química - termoquímica
(FUVEST-2000) Com base nos dados da tabela,
| Ligação | Ligação Energia de ligação (kJ/mol) |
| H-H | 436 |
| Cl-Cl | 243 |
| H-Cl | 432 |
pode-se estimar que o ΔH da reação representada por
H2(g) + Cl2(g) → 2HCl(g)
dado em kJ por mol de HCl(g), é igual a:
a) –92,5 b) –185 c) –247 d) +185 e) +92,5
(FUVEST-2007) A dissolução de um sal em água pode ocorrer com liberação de calor, absorção de calor ou sem efeito térmico. Conhecidos os calores envolvidos nas transformações, mostradas no diagrama que segue, é possível calcular o calor da dissolução de cloreto de sódio sólido em água, produzindo Na+ (aq) e Cl- (aq) .
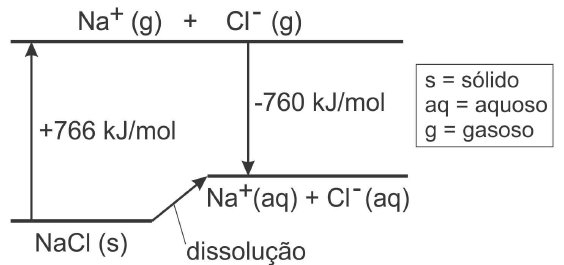
Com os dados fornecidos, pode-se afirmar que a dissolução de 1 mol desse sal
a) é acentuadamente exotérmica, envolvendo cerca de 103 kJ.
b) é acentuadamente endotérmica, envolvendo cerca de 103 kJ.
c) ocorre sem troca de calor.
d) é pouco exotérmica, envolvendo menos de 10 kJ.
e) é pouco endotérmica, envolvendo menos de 10 kJ.
(FUVEST-2010) O “besouro bombardeiro” espanta seus predadores, expelindo uma solução quente. Quando ameaçado, em seu organismo ocorre a mistura de soluções aquosas de hidroquinona, peróxido de hidrogênio e enzimas, que promovem uma reação exotérmica, representada por:
C6H4(OH)2(aq) + H2O2(aq) → C6H4O2(aq) + 2 H2O(l)
O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔH = +177 kJ . mol-1
H2O(l) + ½ O2(g) → H2O2(aq) ΔH = +95 kJ . mol-1
H2O(l) → ½ O2(g) + H2(g) ΔH = +286 kJ . mol-1
Assim sendo, o calor envolvido na reação que ocorre no organismo do besouro é
a) -558 kJ.mol-1
b) -204 kJ.mol-1
c) +177 kJ.mol-1
d) +558 kJ.mol-1
e) +585 kJ.mol
