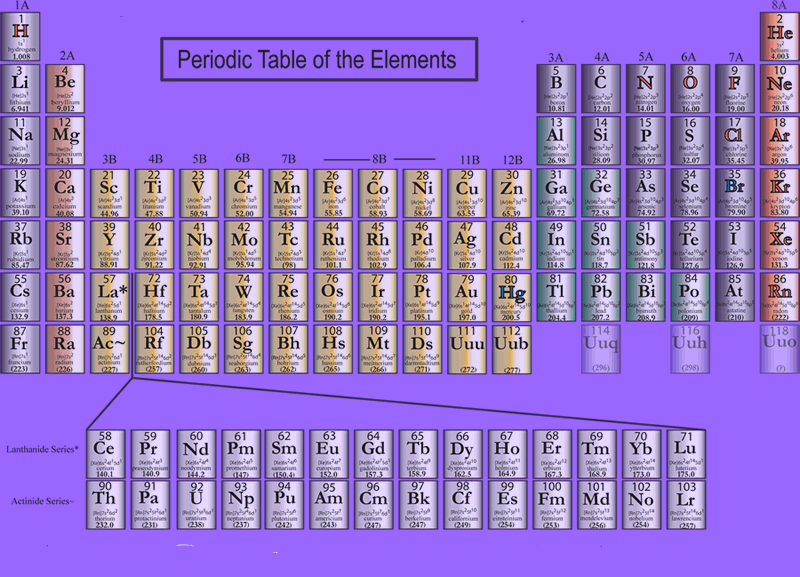
Química > Básica >A tabela periódica dos elementos
A tabela periódica nos ajuda muito. Aqui falarei apenas dos aspectos mais básicos
Desde a antiguidade até o ano 1700 apenas 15 elementos eram conhecidos. A partir do século XVIII muitos mais elementos começaram a ser descobertos e em 1840 cinquenta e cinco elementos já eram conhecidos.
Não se sabia quantos mais elementos seriam descobertos? 50? 100? Mil? Para que tantos elementos? Esses questionamentos levaram à necessidade de classificar os elementos, na forma de uma tabela ou gráfico.
Uma das poucas propriedades dos elementos que eram conhecidos era a massa, então a primeira coisa era colocá-los por ordem de massa. Além disso, sabia-se que certos elementos tinham propriedades químicas similares a certos outros. Diversas tabelas foram construídas, mas a melhor foi aquela construída pelo russo Mendeleev. Em sua tabela (que estudamos até hoje), os elementos são ordenados por massa. Além disso, os grupos (colunas) incluem os elementos com propriedades químicas similares, como por exemplo os metais alcalinos que são todos altamente reativos e produzem soluções alcalinas em água. Eles formam o primeiro grupo da tabela.
Mendeleev fez sua tabela em 1869, quando alguns elementos ainda não haviam sido descobertos. Foram deixados espaços vazios na tabela para acomodar estes elementos que estavam para ser descobertos. Esta tabela poderia prever não só que elementos seriam descobertos, mas também a massa aproximada e as propriedades químicas destes. Estes elementos previstos foram eventualmente descobertos, o que consagrou a tabela de Mendeleev e seu poder de fazer previsões. Uma importante característica da ciência é poder fazer previsões.
Nessa época não se conheciam os elétrons, mas assim mesmo pôde-se fazer uma tabela que pode ser explicada pelas distribuições de elétrons:
Cada período (linha) da tabela representa os elementos com um certo número de camadas de elétrons, ou seja, o primeiro período reúne elementos com apenas 1 camada (apenas H e He), o segundo período reúne elementos com 2 camadas de elétrons e assim por diante… Os átomos que possuem mais camadas são maiores, obviamente, então os elementos mais abaixo na tabela são maiores que os mais acima.
Existem muitas outras tendências (trends) reveladas pela tabela e vamos estudar algumas agora, incluindo a eletronegatividade. A imagem abaixo ilustra algumas tendências:
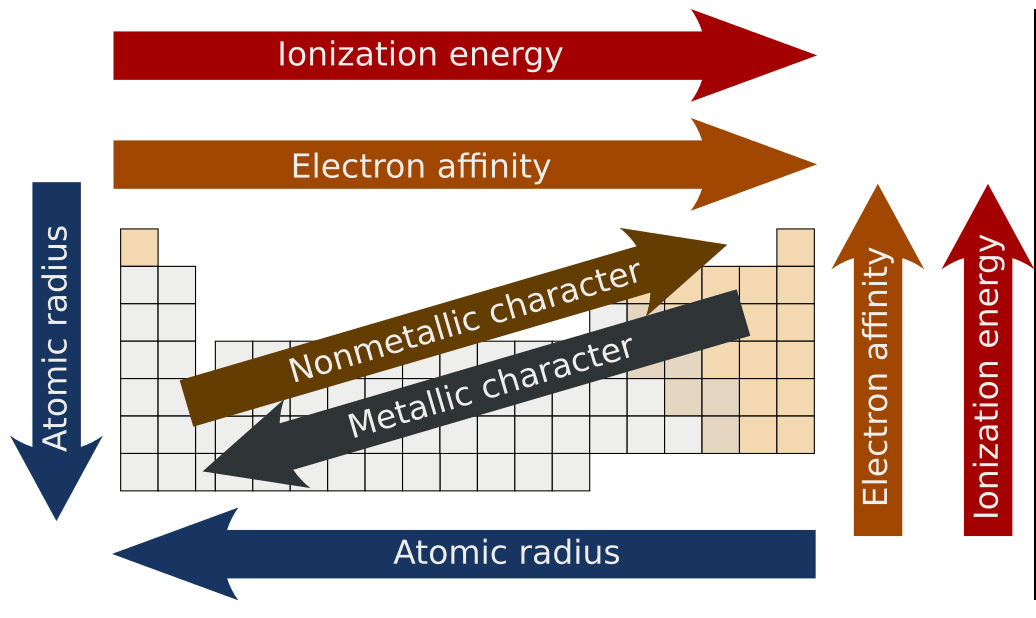
Imagem credito Wikipedia, user Mirek2
Observe que odmetais são representadps pela cor prateada, não-metais pelo bege à direita. Os elementos entre essas duas categorias são os semi-metals. A maioria dos elementos são metais! Observe também outros trends : atomic radius é o raio do átomo (e portanto seu tamanho) e ionization energy é a energia necessária para remover um elétron do átomo.
Repare também que cada elemento na tabela é identificado por um número (acima do símbolo de cada elemento) , que é chamado o número atômico. Eles correspondem ao número de elétrons no átomo, que é igual ao número de prótons no núcleo.
Agora podemos entender a forma da tabela.
revisar a estrutura do átomo>>
O elemento H , o mais simples de todos, possui apenas 1 elétron. O He, o seguinte no período tem 2. Como a camada está completa, passa-se para a segunda camada e portanto para o período de baixo. Esta possui capacidade para 8 elétrons e então teremos 8 elementos diferentes, até completar a camada. Então passamos para a debaixo….
É importante observar que os elementos no último grupo (coluna) da tabela possuem suas camadas completas. Em contraste , os elementos no primeiro grupo possuem apenas 1 elétron na última camada.
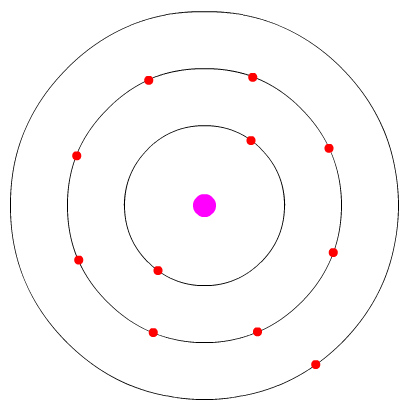
O átomo de sódio possui um elétron apenas na sua última camada
Por que a tabela é chamada de periódica?
Veja que várias tendências oscilam de acordo com os períodos da tabela. O gráfico abaixo ilustra a energia de ionização (energia necessária para remover um elétron da camada de valência- que é a mais externa):
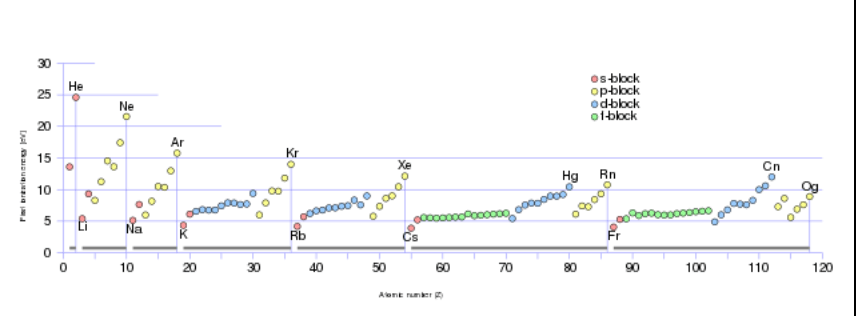
Propriedade periódica - Imagem da Wikipedia, credit: double sharp
Para rever todas as ideias veja o mapa conceitual:
Mapa conceitual :Tabela periódica