Química > Físico-química > Entalpia > Energética das ligações químicas - introdução
Uma reação química consiste da quebra de ligações químicas em um composto (reagente) e da subsequente formação de ligações químicas em outro (produto). Novos compostos são produzidos em reações químicas.
As ligações químicas mais estáveis são as mais fortes, ou seja, as mais difíceis de quebrar. Mais energia é necessária para quebrá-las. Assim como energia é liberada quando da formação das ligações químicas, energia é “consumida” para fazer a quebra delas. A quantidade de energia é a mesma nos dois casos.
As energias das ligações químicas já foram todas medidas e por isso existem tabelas com todos esses números, onde consta por exemplo N≡N , que é a ligação tripla entre 2 átomos de nitrogênio. Ligações triplas são as mais fortes, seguidas das duplas e das simples, que são as mais fracas. Por exemplo O=C é a ligação dupla entre carbono e oxigênio como por exemplo na molécula de CO2 (onde existem 2 ligações O=C) . Em monóxido de carbono, C≡O , a ligação é tripla. A ligação simples encontramos, por exemplo entre carbonos: C-C. Esta é uma ligação muito importante pois a habilidade do carbono de ligar a si próprio permite a formação de longas moléculas, necessárias para produzir a complexidade dos seres vivos. Proteínas e DNA por exemplo consistem de longos polímeros (moléculas gigantes que consistem da repetição de moléculas menores). Estas classificações estão relacionadas a quantos elétrons participam dessas ligações: um traço entre os átomos (cmo em C-C) representa uma ligação simples, que consiste de 1 par de elétrons. As ligações duplas e triplas consistem de 2 e 3 pares de elétrons respectivamente.
Perceba que durante a combustão de gasolina, por exemplo, forma-se muito CO2 e por isso muita energia é liberada, já que as ligações C=O são fortes . Explosivos (como TNT) costumam ter bastantes nitrogênios e formar ligações triplas (N≡N) de modo que se produza muita energia (e gás também para a onda de choque da explosão).
Algumas reações químicas
Pense em ligações químicas muito estáveis: a ligação N≡N forma o gás nitrogênio que constitui 80% da nossa atmosfera, e permanece na forma de gás mesmo sendo tão necessário para para alimentar as plantas (fertilizantes) e também para a fabricação de muitos produtos, como explosivos. Para existir em tanta abundância ele precisa ser muito estável. Ainda assim é possível promover reações químicas que fixam o nitrogênio, ou seja, que o transfiram da atmosfera para algum composto que possa ser utilizado na prática. No entanto, estas não são reações fáceis. Os humanos conseguiram fixar nitrogênio por meio do processo de Haber, descoberto na Alemanha no inicio do século XX. Nitrogênio era necessário para fabricar explosivos e a Alemanha não dispunha de nitratos no seu solo (fórmula da pólvora: nitrato - de sódio ou potássio, enxofre e carvão) . Por isso foi crucial durante a guerra porque havia um bloqueio na importação de nitratos do Chile. O processo de Haber não é fácil: requer pressões; a descoberta crucial (breakthrough) para viabilizar o processo foi o uso de ferro como catalisador. Sem ele as pressões teriam que ser tão altas que o processo seria inviável, porque sai caro reforçar todo os seus reatores, válvulas etc. E o perigo de explosão também é agravado, porque a consequências seriam bastante trágicas. O processo de Haber permitiu a fabricações de insumos agrícolas contendo nitrogênio (na forma de amônia ou nitrato) e portanto um nível de produção de alimentos muito mais elevado. Isso permitiu uma grande expansão da população mundial.
Muito antes que os humanos, as bactérias já fixavam o nitrogênio: graças a elas a humanidade pôde aprender a desfrutar do feijão e outros legumes que são ricos em proteínas (moléculas que possuem nitrogênio).
Outra ligação bastante estável é a O-H. Duas destas estão presentes na água. Se não fosse tão estável, a água não poderia cobrir a maior parte do nosso planeta. Assim como a formação do N≡N libera muita energia (como ó caso em diversos explosivos), a formação de O-H também : esta reação era usada como combustível do ônibus espacial, que possuía tanques com hidrogênio e oxigênio no estado líquido ( 2 tanques separados, claro….).
Outro exemplo de ligação forte, embora seja um aligação simples, é a ligação Si-O (silício-oxigênio). Esta é a que constitui a maioria das pedras! E lembremos que todo o solo provem das pedras que se desmancham e se formam novamente em um ciclo.
Por fim pensem no CO (dióxido de carbono). É uma preocupação mundial livrar-se dele, que é muito venenoso (provoca morte por asfixia) mas difícil de quebrar. A sua formação libera, portanto, muita energia. Combustões geralmente produzem CO, embora fosse melhor produzir apenas CO2, porque com a formação de duas ligações C=O se libera mais energia.
As reações mais energéticas
Estas são normalmente aproveitadas onde se precisa muita energia, como é o caso dos combustíveis em geral e explosivos. Combustíveis de foguete em particular devem ser altamente energéticos. O ônibus espacial (space shuttle) usava combustível líquido e sólido. Os boosters de combustível sólido continham alumínio , entre outros componentes. Perceba que a entalpia de formação do óxido de alumínio é bastante alta. E por isso sua formação com a reação de alumínio metal com oxigênio libera enormes quantidades de energia. Nesse caso o alumínio deve ser um pó muito fino.
Em outras misturas como a pólvora, os ingredientes (carvão, nitrato de potássio e enxofre) devem ser moídos muito finamente, e muito bem misturados, para que a reação possa ocorrer o mais rápido possível. Na pólvora, não há a necessidade de acesso ao oxigênio do ar porque o nitrato contém vários oxigênios.
No caso dos altos explosivos o oxigênio está ainda mais facilmente disponível para os combustíveis: ele está na mesma molécula. É necessária apenas uma ativação para que a molécula se rompa e os oxigênios se aproximem dos átomos que funcionam como combustível, como o carbono ou enxofre.
Reações exotérmicas e endotérmicas
Reações que liberam energia (como as discutiss aqui acima)são chamadas de exotérmicas (exo -fora). As que invés de liberarem, consomem (ou absorvem) energia, são chamadas de endotérmicas (endo - dentro).
Compostos mais energéticos liberam energia e se transformam em compostos menos energéticos, conforme ilustrado no gráfico:
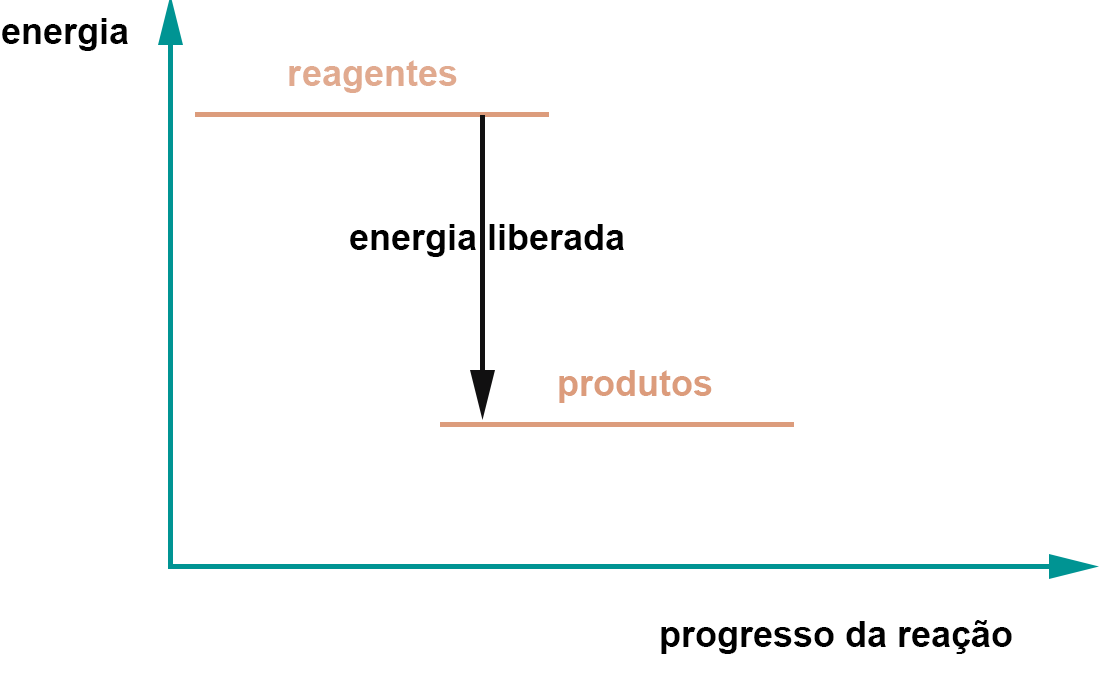
gráfico ilustrando uma reação exotérmica
Um exemplo de composto energético é o carvão, ou a gasolina. Após reagirem com o oxigêniio formam dióxido de carbono e água, substÂncias das quais não podemos extrair energia tão facilmente. As reções exotérmicas vao produzindo compostos mais abaixo no gráfico. Portanto um sistema isolado acabará com todasd as suas moléculas na parte mais baixa do gráfico e nada mais ocorrerrá! A energia é o que faz as coisas acontecerem.
Um planeta em que seus compostos estejam todos na parte bbaixa do gráfico é um planeta morto.
Por sorte temos o sol que fornece a energia necessária para fechar o ciclo e produzir compostos energétios (como glicose produzida na fotossíntese) e portanto manter a vida no planeta por bilhões de anos.
Este gráfico pode mostrar mais detalhes, como no exemplo abaixo:
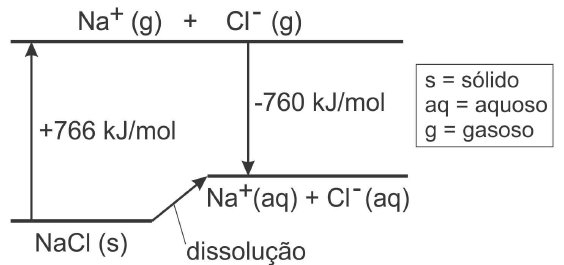
Questão FUVEST 2007
Perceba que setas para cima representam processos endotérmicos, e setas para baixo exotérmicos (como no gráfico anterior).
Este gráfico pretence a FUVEST-2007 e a questão resolvida encontra-se aqui.
© Ricardo Esplugas de Oliveira, 2021
