Química > Equilíbrio > Introdução
Uma reação química pode voltar atrás? Ou seja, podem os produtos da reação se transformar nos reagentes?
Resposta: Sim, é possível. Embora muitas das reações que costumamos ver, como queimas e explosões, sejam irreversíveis (não podem voltar) existem algumas que podem. Aliás, há reações químicas que vão para frente e para trás ao mesmo tempo! Isso é o que chamamos de equilíbrio químico, que é representado por duas flechas, uma apontando a direção de ida e a outra a de volta:
N2O4 ⇌ 2NO2
Características do equilíbrio químico:
1) Quando uma reação química encontra-se em equilíbrio, as quantidades de todos os participantes (reagentes e produtos) são constantes. Isso não significa que a reação parou. O equilíbrio é dinâmico, ou seja, regentes e produtos estão sendo formados e decompostos todo o tempo.
2) Uma catalisador não altera o equilíbrio, ou seja, as quantidades de cada participante continuam as mesmas. Isso ocorre porque o catalisador acelera a reação para a frente e também a reação para trás.
Exemplo de equilíbrio químico envolvendo óxidos de nitrogênio na forma gasosa (esta é a mesma equação já mostrada a cima):
N2O4 ⇌ 2NO2
Nessa representação , a reação para a frente é a formação de NO2 e a reação para trás é a formação do N2O4 .Essa reação é muito interessante porque os gases tem cores diferentes e as transformações podem ser observada diretamente. Isto será particularmente interessante quando quisermos "empurrar" o equilíbrio para frente ou para trás, com veremos na seção sobre o princípio de Le Chatelier.
velocidades de reação
Equilíbrio é alcançado quando a velocidade d areação para frente é igual à velocidade da reação para trás. Sabemos que a velocidade de reação é dada pela constante k multiplicada apela concentração de cada reagente. Continuando com nosso exemplo temos:
Reação pra frente:
N2O4 → 2NO2
rate = kf [N2O4]
Reação pra trás:
2NO2 → N2O4
rate = kr [NO2]2
A constante de equilíbrio - Kc
Quando a reação está em equilíbrio, estas velocidades devem ser iguais e portanto:
kf [N2O4] = kr [NO2]2
kf / kr = [NO2]2 / [N2O4] = Kc
O valor de Kc para esta reação é 4,6 x 10-3 na temperatura de 25 °C . Estudaremos também como o equilíbrio muda em resposta à variações de temperatura. Neste caso o valor de Kc é muito pequeno, o que indica que a concentração de equilíbrio de NO2 é muito maior que a de N2O.
Exemplo de cálculo de Kc:
Usando ainda o mesmo exemplo, calcule a concentração de equilíbrio de N2O4 no caso em que a de NO2 é 0.1 mol de NO2.
[NO2]2 / [N2O4] = Kc = 4,6 x 10-3
Inserindo a concentração de NO2:
(0,1)2 / [N2O4] = 4,6 x 10-3 ==> N2O4] = 1*10-2 / 4,6 x 10-3 = (1/4,6)(10-2/10-3) = 0.21 *10 = 2,1
O caminho para o equilíbrio
Imagine agora a seguinte situação: o reator encontra-se vazio e inserimos apenas N2O4. Este irá reagir para formar NO2 até que as quantidades de equilíbrio sejam estabelecidas, conforme os gráficos abaixo:
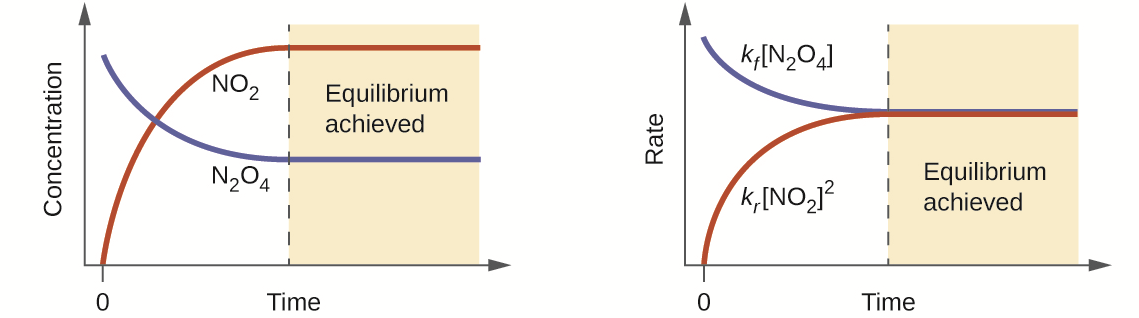
Gráficos ilustrando o caminho para o equilíbrio. Fonte: wikipedia(adaptado)
No gráfico da esquerda observa-se as variações das concentrações. A de NO2 é zero inicialmente. À mediada que NO2 se forma, a concentração de N2O4 diminui. Depois que o equilíbrio é alcançado, os gráficos são linhas paralelas ao eixo horizontal.
No gráfico À direita estão as variações das velocidades (rate) de reação. Como estas dependem da concentração, elas variam até ficarem iguais, no equilíbrio.
Cálculos envolvendo pressões parciais - a constante de equilíbrio Kp
A constante de equilíbrio - Kc - é baseada nas concentrações. No caso de reações envolvendo gases (como no exemplo acima) é mais conveniente usar as pressões parciais invés das concentrações. A constante de equilíbrio escrita assim chama-se Kp. Portanto, no exemplo acima:
Kp = P2 NO2 / P N2O4
e portanto análoga a:
Kc = [NO2]2 / [N2O4]
Cálculos envolvendo solubilidade - a constante de equilíbrio Kps
Kps ou produto de solubilidade é usada para substâncias pouco solúveis.
No caso do AgCl por exemplo, temos:
AgCl(s) ⇌ Ag+ + Cl-
Kps = [Ag+][Cl-]
A concentração do sal (AgCl) no estado sólido tem o valor = 1 e por isso não aparece.
Cálculo
A solubilidade pode ser calculada a partir do Kps, da seguinte forma:
Kps = [Ag+][Cl-] = x2 = 1.77*10−10
Isso decorre do fato de as concentrações de ambos íons serem iguais.
x = 1.33*10−5 M
índice geral do curso de química >>
© Ricardo Esplugas de Oliveira, 2020
