Química > Orgânica > Estrutura e representação das moléculas orgânicas
Desenhos para representar moléculas
As moléculas orgânicas possuem esqueletos de carbono que podem ser representado apenas por linhas:
Como disse na introdução, aprender a química orgânica é como aprender uma nova língua. Iniciarei mostrando os desenhos usados para representar as moléculas, que serão a linguagem básica de tudo. Podem parecer complicados inicialmente mas logo se percebe que são a maneira mais simples e econômica de representar as longas e complicadas moléculas, cheias de carbonos e hidrogênios. Os carbonos são o esqueleto da molécula, aos quais de ligam os hidrogênios.
No caso mais geral, podem haver também oxigênio, nitrogênio, enxofre e outros. Assim se formam grupos funcionais como por exemplo álcool, éter, etc... Como quase sempre há muitos carbonos e hidrogênios, é uma boa ideia representá-los de forma simples, de preferência apenas por uma linha (fórmula esqueletal), como veremos abaixo. Os outros átomos são representados explicitamente.
Comecemos com algumas moléculas simples:
Abaixo mostramos o pentano, que é um hidrocarboneto, ou seja, é feito apenas de carbono e hidrogênio como vemos abaixo.
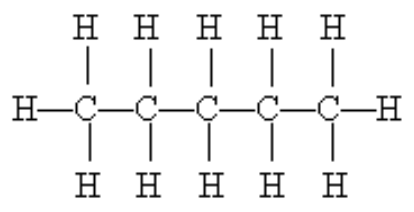
fórmula estrutural do pentano, mostrando seus 5 carbonos, cada um fazendo 4 ligações
O prefixo pent- significa 5, como em pentágono ou pentacampeão. No caso, 5 carbonos. A lista dos pefixos relacionados aos números de carbonos está aqui.
Nomenclatura :
| Número decarbonos | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Prefixo | Met | Et | Prop | But | Pent | Hex | Hept | Oct | Non | Dec | Undec | Dodec | Tridec | Tetradec | Pentadec | Hexadec | Heptadec | Octadec | Nonadec | Icos |
Arraste a tabela para ver mais dados (Tabela da Wikipedia)
Na fórmula esqueletal não precisa escrever os hidrogênios ; cada vértice (canto) e cada extremidade da figura representa um carbono. Dessa forma o pentano fica assim:
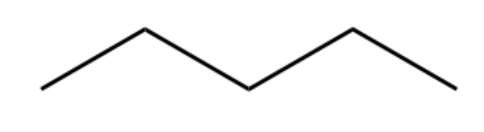
fórmula esqueletal do pentano
Essa fórmula esqueleta é mais simples e , além disso, ela nos trás mais informação: ele mostra a geometria da molécula. Este ângulos existem de fato. As moléculas de hidrocarbonetos não são retas, como por exemplo a do CO2.
Os hidrogênios não aparecem mas não é necessário. Sabemos que cada carbono faz 4 ligações, então haverá suficientes hidrogênios para completá-las (veja mais sobre isso em grau de insaturação).
A representação "ball and stick" (abaixo) também ilustra a geometria molecular. Esta representação aparecerá bastante nesse curso, apenas para ajudar na visualização. Mas não se preocupe porque você só precisa desenhar a representação esqueletal, que é a mais simples, embora possa levar alguns dias para acostumar.
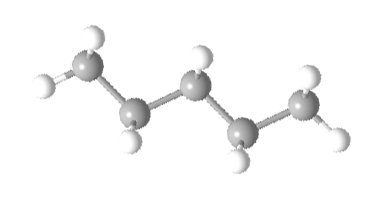
Representação ball and stick do pentano
Abaixo outro exemplo, dessa vez uma molécula mais longa, a gasolina (octano):
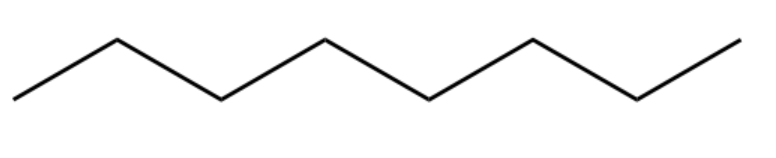
Representação esqueletal do octano
A fórmula esqueletal nos permite desenhar longas moléculas com facilidade. Por exemplo as moléculas de parafina são hidrocarbonetos que podem ter entre 20 e 40 carbonos. Abaixo uma de 20 carbonos, o icosano (lembre que um poliedro de 20 lados é um icosaedro).

Representação esqueletal do icosano
Sim, os prefixos nos nomes indicam quantos carbonos temos. Aquele de 10 carbonos será o decano, e assim por diante... Diversas moléculas podem ser formadas para 1 determinado número de carbonos. As cadeias podem também ser ramificadas ou fechadas.
Gasolina: A gasolina é uma mistura de vários octanos diferentes, incluindo também cadeias fechadas. Note que todas tem 8 carbonos:

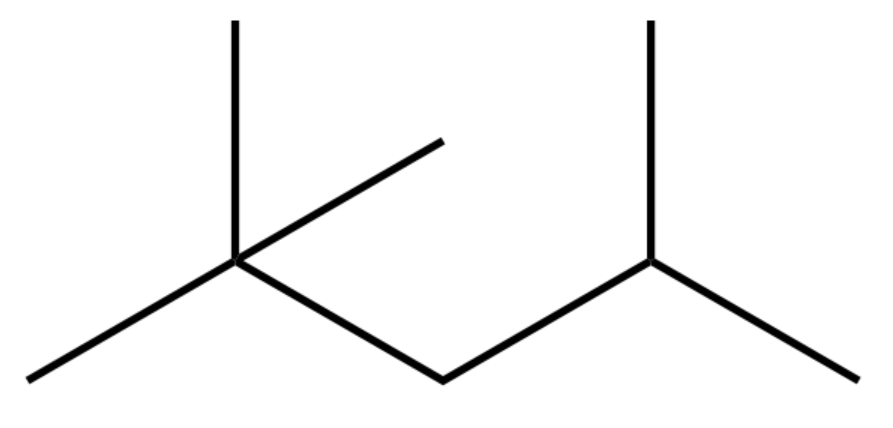
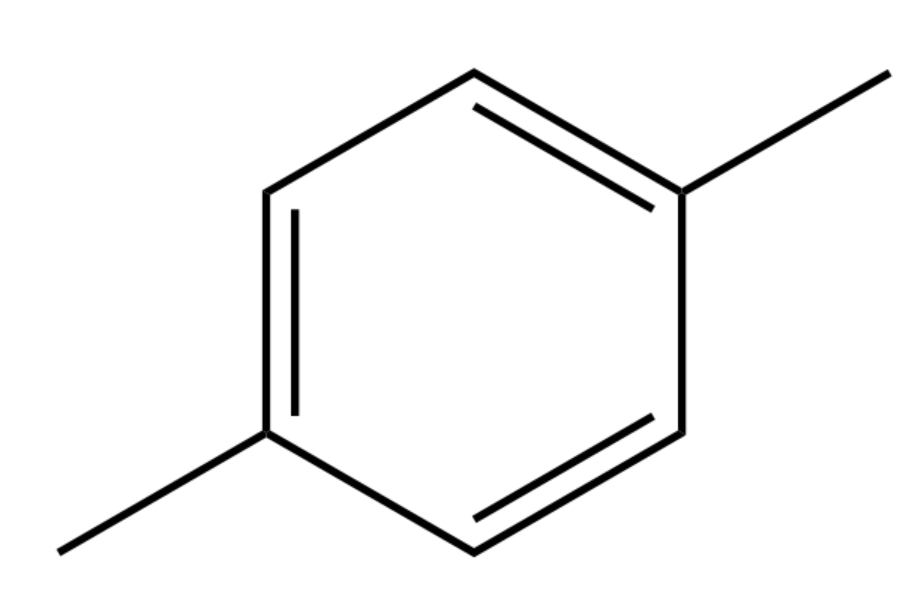
exemplos de octanos na gasolina:octano, isoctano e metil tolueno (de cima para baixo)
De fato há 18 maneiras diferentes de se escrever um octano (essas se chamam isômeros), todos com 8 carbonos e 18 hidrogênios! Ou seja, 15 a mais das 3 que vimos acima. Imagine então um hectano (100 carbonos)? hehehe . Quanto mais carbonos, maior o número de isômeros. Mas não se preocupe que você não vai ter que encarar coisas muito grandes ou complicadas.
No caso do metil tolueno acima, houve mais uma novidade (além da cadeia fechada): a ligação dupla. Há 3 ligações duplas nesta estrutura. Falaremos mais sobre elas na seção grau de insaturação. De momento direi apenas que ligações duplas são mais fortes que as simples, e portanto a distância entre os carbonos (comprimento da ligação) diminui.
Funções orgânicas
Consulte aqui a tabela completa das funções orgânicas. De momento mostrarei a função álcool. como um exemplo:
Etanol
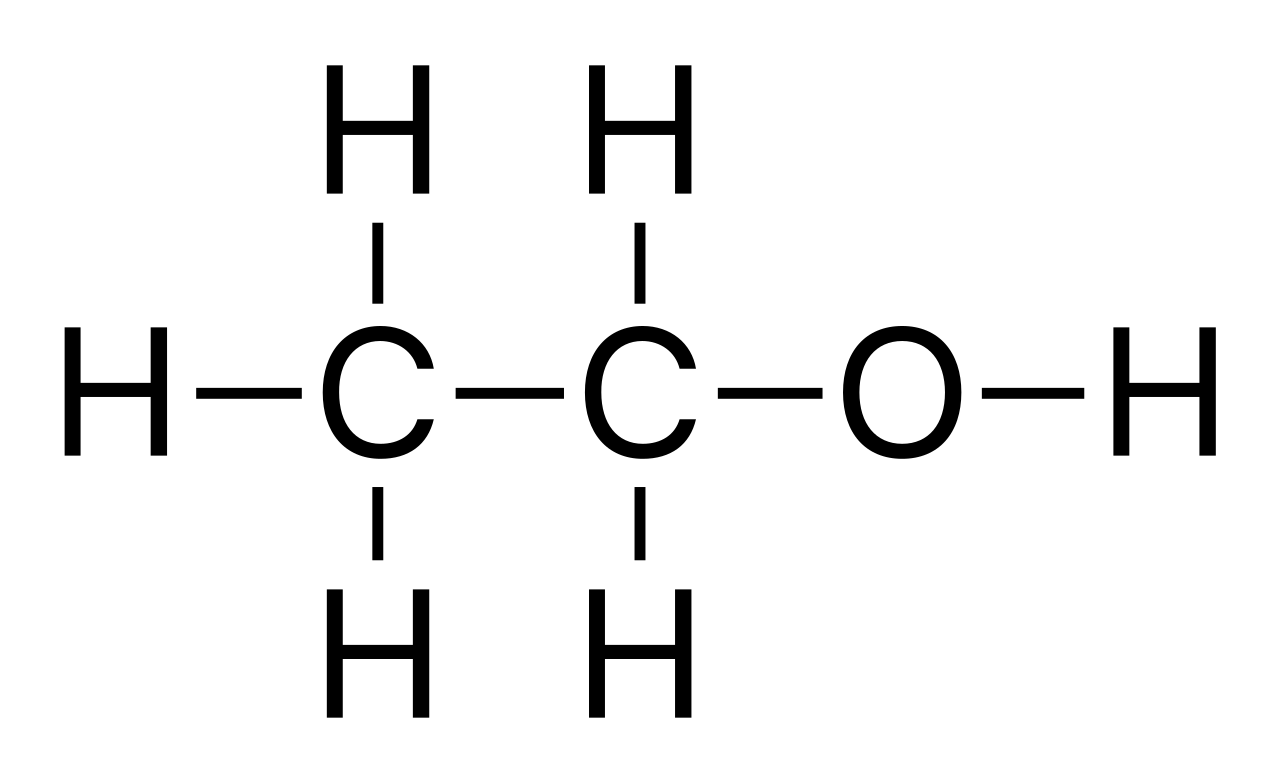
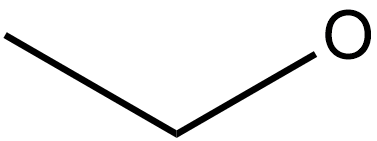
Acima há duas representações da molécula de ethanol. Perceba que a da direita (esqueletal) dá menos trabalho para fazer e, a meu ver, é mais clara também , embora seja necessário um pouco de prática. NA fórmula esqueletal não se escrevem os hidrogênios e os carbonos são os vértices (cantos) na linha. Além dessa economia, ela oferece informação sobre a estrutura espacaila da molécula, ou s eja, que ela tem de fato essa forma "dobrada". Veja abaixo uma representação "ball and stick" do ethanol:
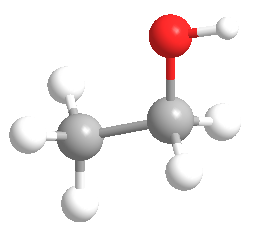
Nota-se claramente que a fórmula esqueletal é a mais rápida de se desenhar, e por isso é a mais usada. Às vezes são usados desenhos intermediários entre a esqueletal e a estrutural, o que não é problema . Por exemplo na prova da FUVEST de 2004 aparece uma estrutura assim:
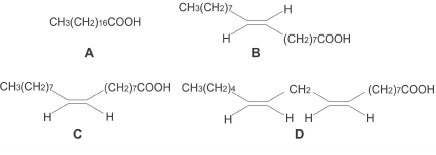
Imagem extraída de questão de química orgânica da FUVEST.
Nas estruturas acima nota-se que apenas a região das ligações duplas é representada pela fórmula esqueletal. É comum essa mistura de fórmulas em uma só... Nessa caso economiza espaço e trabalho porque os parenteses representam 7 repetições, por exemplo.
No decorrer deste curso você verá inúmeras fórmulas esqueletais e outras...
© Ricardo Esplugas de Oliveira, 2020
