Química > Orgânica > Grau de insaturação
Refere-se à relação entre carbonos e hidrogênios na molécula orgânica
INTRO
Observe como exemplo o etano (molécula saturada) e o eteno (molécula insaturada):
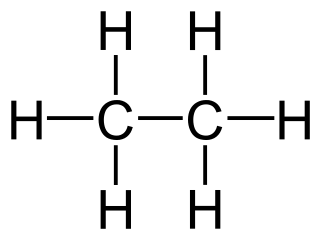
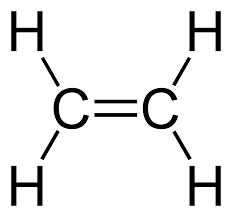
O etano (acima) possui 2 carbonos e 6 hidrogênios; o eteno (abaixo) também possui 2 carbonos, mas tem 4 hidrogênios,apenas, devido à dupla ligação entre carbonos.
O etano está saturado de hidrogênios, ou seja, possui o máximo número de hidrogênios possível. O eteno, diferentemente, é uma molécula insaturada.
Esses conceitos são muito usados no contexto de gorduras. As gorduras saturadas são consideradas mais nocivas ao organismo e por isso as embalagens de alimentos fornecem a informação da quantidade de cada tipo de gordura no produto. Da mesma forma que descrevemos para o caso etano/eteno, as gorduras insaturadas são as que apresentam ligações duplas. Abaixo analisaremos questões da FUVEST e ENEM sobre este tema.
Grau de insaturação
No caso do eteno, que possui apenas uma ligação dupla, o grau de insaturação é 1. No caso de um ácido graxo (sim, daqueles que formam gorduras) por exemplo, o ácido linoléico, o grau de insaturação é 2.
A fórmula do etano é C2H6 e a do etano é C2H4. Nesse caso é fácil dizer que há uma ligação dupla, pois se vê que um tem menos hidrogênios. Mas no caso de algo mais complicado como C17H33CO2H (ácido oléico), ficaria mais difícil determinar isso. Precisaríamos calcular.
Veremos que é um cálculo simples, mas muito importante. Se tivermos uma molécula que pelo seu peso, determinado no laboratório, sabemos que tem fórmula C6H10, como descobrir sua estrutura. Um conhecimento do grau de insaturação já facilitaria bastante este trabalho, como veremos a seguir.
Cálculos
No caso dos alcanos e alcenos, por exemplo, temos fórmulas gerais do tipo:
(I) Alcanos C2nH2n+2
(ii) Alcenos C2nH2n
Podemos verificar facilmente que a fórmula acima funciona para o etano/eteno, usando n=1.
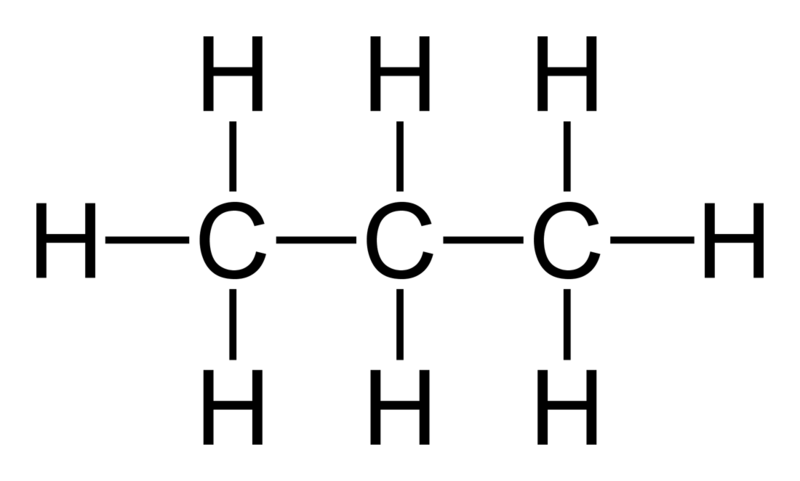
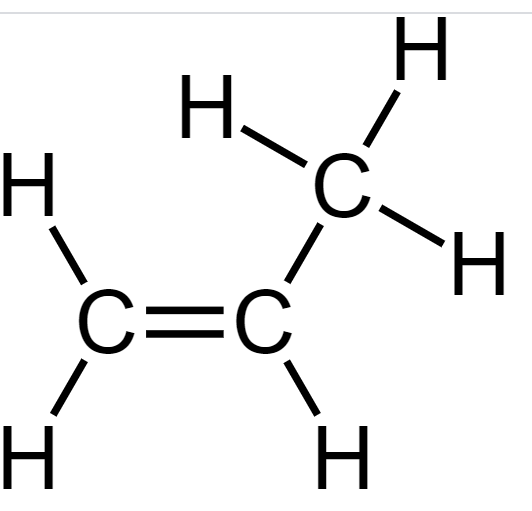
Usando n=1,5 temos uma dupla de moléculas também muito importante industrialmente, : o propano e o propeno. O propano, seria o C3H8 e o propeno C3H6. Nossas fórmulas (I e II) novamente funcionam.
Caso se esqueça a fórmula, basta comparar o etano e eteno e se deduz a fórmula facilmente.
Exemplo de cálculo
-Para hidrocarbonetos
Ligações duplas e aneis
O hidrocarboneto C6H10 mencionado acima, tem 6 carbonos. Sabemos que não é um hexano, pois este teria formula C2*3 H(2*3)+2 e portanto C6H14.
Em comparação com o hexano, esta molécula tem 4 hidrogênios a menos e portanto duas insaturações. Seu grau de insaturação é 2. Estas podem ser duas ligações duplas, mas há outras possibilidades também.
Se a molécula se fecha na forma de um anel, 2 hidrogênios são descartados, de modo que para este cálculo o anel é equivalente à uma ligação dupla. Poderíamos ter uma molécula em anel, e mais uma insaturação, o que equivaleria Às duas insaturações. Ou poderíamos ter uma ligação tripla, o que corresponderia tambémàs duas insaturações. Existem várias possibilidades, mas já temos uma ideia de como será a molécula buscada.
As possibilidade descritas acima são para hidrocarbonetos, moléculas que possuem apenas C e H. Para moléculas orgânicas em geral, teremos também a presença de outros átomos como oxigênio, nitrogênio ou halogênios.
-Para moléculas orgânicas em geral
Neste caso, além das considerações acima, temos que olhar o seguinte:
Os halogênios funcionam como um hidrogênio. Portanto cada halogênio conta como 1 hidrogênio, no cálculo da insaturação. Quer dizer, somamos estes ao total de hidrogênios.
Oxigênio não afeta a contagem de hidrogênios e portanto pode ser ignorado.
Nitrogênio: Neste caso a molécula possui um hidrogênio a mais do que teria sem o nitrogênio. Quer dizer, subtraímos o número de nitrogênios do total de oxigênios.
OBS. No caso do oxigênio e nitrogênio isto só funciona no caso de ligações simples (nada de duplas ou triplas). Veremos também um exemplo sobre o que acontece quando há ligação dupla.
EXEMPLOS
Vamos primeiramente calcular a insaturação em um hidrocarboneto.
1) icosano , cuja fórmula é C20H42 . Pela fórmula (I) vemos que não há insaturações.
2) beta caroteno - C40H56 . Pela fórmula (I) , esse número de carbonos produziria um alcano com 82 hidrogênios. Como há apenas 56, trata-se de uma molécula com insaturações. O total é (82-56)/2 = 13 insaturações. Podemos imaginar uma molécula com diversas ligações duplas e anéis. A estrutura é esta:
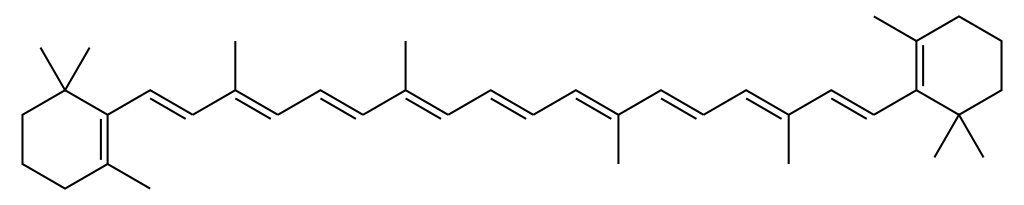
Vemos que há 11 ligações duplas e 2 aneis, totalizando as 13 insaturações calculadas.
Insaturação em molécula com oxigênio: colesterol Sua fórmula é C27H46O. Colesterol é sintetizado por todos os animias e é um componente essencial da membrana celular. Seus 4 aneis oferecem rigidez.
O alcano correspondente teria 2*27+2 = 56 hidrogênios. Existem apenas 46 portanto faltam 10H (sabemos que o O pode ser ignorado) e concluímos que há 5 insaturações.
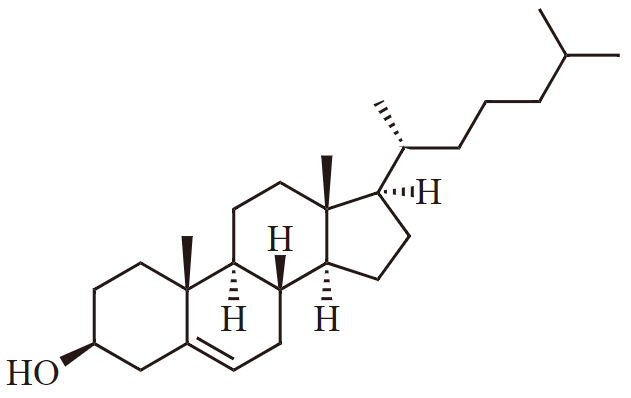
A fórmula acima indica que de fato há 5 insaturações: 1 ligação dupla e 4 anéis. Perceba que o colesterol é um álcool, porque possui o grupo -OH . Por isso recebe a terminação -ol, como em etanol.
Insaturação em molécula com nitrogênio: Metanfetamina Sua fórmula é C10H15N. Esta ficou famosa após a série Breaking Bad. Leia mais aqui.
O alcano correspondente teria 2*10+2 = 22 hidrogênios. Lembrando que um N subtrai um H, o total é de 14 H, portanto 8H a menos do que na molécula saturada.Portanto 4 insaturações. Vamos checar este resultado olhando para a estrutura da metanfetamina:
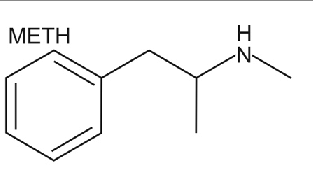
Formula estrutural da metanfetamina
Nota-se que as 4 insaturações são o anel e as 3 ligações duplas (também no anel)
Insaturações em ácidos graxos
Esta questão é frequente em vestibulçares, e por isso incluirei este último tópico de insaturação, com links para FUVEST e ENEM.
Os ácidos graxos possuem uma ligação dupla C=O (no grupo funcional ácido) e portanto não pode ser submetido à regra acima que só funciona quando há apenas ligações simples entre C e N ou O. Mas o efeito de uma ligação C=O é fácil de prever: são 2 H a menos. Portanto temos a forma:
(III) CnH2nO
Com base nesta regra específica, vamos estudar alguns ácidos graxos.
ácido decanóico
O ácido decanóico (-deca é o prefixo para 10 carbonos e -óico é o sufixo para ácido) possui fórmula C10H20O2. O correspondente alcano, pela regra específica para ácidos graxos-III (em que 2 oxigênios faltam devido à ligação C=) , teria mesmo 20 hidrogênios e portanto temos um ácido graxo saturado:
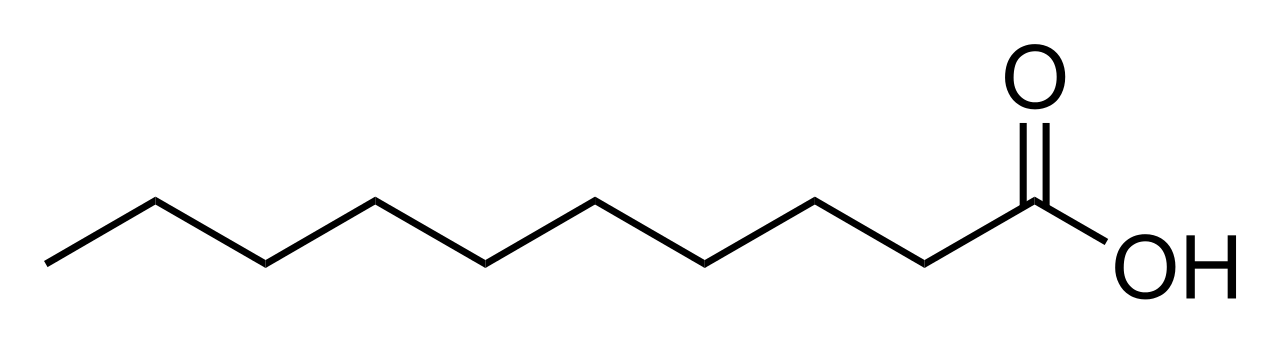
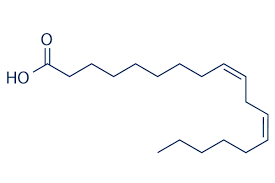
ácido linoléico
Normalmente ele é encontrado na forma de triglicérido (3 moléculas de ácido graxo ligadas a uma de glicerol). Ele compõe, por exemplo, 51% do óleo de soja e 59% do óleo de milho. Sua fórmula molecular é a C18H 32 O2 . Pela regra (III), um ácido saturado teria 2*18 = 36 H, portanto estariam faltando 4, o que significa 2 insaturações, que consistem de 2 ligações duplas, como se vê abaixo:
EXEMPLO: Quantos hidrogênios na molécula de Prozac?
Agora um cálculo um pouco difernete, na molécula de Fluoxetien, mais conhecida pelo nome comercoial de Prozac. O Prozac é um dos anti-depressivos (entre outros usos) mais consumidos no planeta, e tem sido fornecido até a soldados americanos para lidar com o stress da guerra. Esta droga está incluída até na lista dos Medicamentos Essenciais da Organização Mundial de Saúde .
Tente usar as fórmulas para determinar quantos hidrogênios há nesta molécula. Você poderia fazer isso contando-os, mas essa conta se torna mais trabalhosa para moléculas maiores.
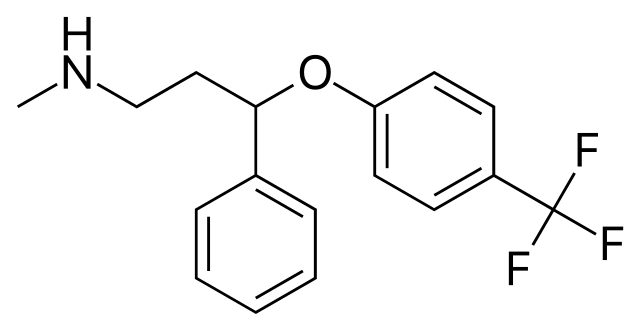
A estrutura possui 17 carbonos. Pela fórmula teríamos 2*17+2 = 36 hidrogênios- H- no caso da molécula saturada. Os flúors -F - ocupam o lugar do H e portanto os 3 F representam 3 H a menos.. O oxigênio também não muda nada. Devido à presença de N , soma-se 1 H. As seis ligações duplas e os dois anéis representam 8 insaturações no total, e portanto 16 H a menos.
Portanto a resposta é 18 H e a fórmula molecular , portanto, é
C17H18F3NO
© Ricardo Esplugas de Oliveira, 2020
