Química > Básica > Forças intermoleculares
Moléculas se atraem umas às outras formando líquidos e sólidos. Se não houvesse essa atração, teríamos gases apenas. Ou seja não existiríamos
Estas são diretamente responsáveis pelo estado físico (sólido, líquido ou gasoso) de um material e também por outras características. Para que líquidos e sólidos possam existir, é necessário que as moléculas se atraiam mutuamente.
Quanto mais fortes as forças intermoleculares numa certa substância, mais as moléculas querem estar juntas, no estado sólido. Temperaturas mais altas seriam necessárias para causar a fusão dos sólidos onde as forças intermoleculares são mais intensas. As moléculas de água se atraem fortemente (como explicaremos abaixo) e por isso a água é um líquido com propriedades muito especiais, como a tensão superficial.
Quanto mais intensas as forças intermoleculares, mais altos os pontos de fusão e ebulição. Veja que para ferver a água demora um tempinho...
Moléculas que tem forças intermoleculares fraquinhas tendem a ser gases, à temperatura ambiente..
As forças intermoleculares são baseadas no conceito de moléculas polares e apolares , e por isso recomendo uma revisão deste capítulo.
A força é de origem eletrostática, mas entre moléculas (ou átomos no caso dos gases nobres) neutras, quer dizer, sem carga elétrica. O que acontece é que quando a "Nuvem" de elétrons se deforma, passa a existir mais elétrons de um lado do que do outro o que dá origem a uma carga elétrica , embora a molécula inteira (ou átomo) continue neutra. Isso pode ocorrer de 3 maneiras diferentes, dando origens às forças de van der Walls, dipolo-dipolo e ponte de hidrogênio.
Não confundir forças intermoleculares com as ligações químicas covalentes, que são responsáveis pela formação de moléculas
Forças de Van der Walls
Devido ao movimento aleatório dos elétrons ao redor das moléculas, pode haver um determinado instante em que há mais elétrons de um lado que de outro, o que confere uma pequena carga negativa ao lado com mais elétrons.
Um vídeo de uma nimação do movimento dos elétrons facilita o entendimento desta ideia:
Vídeo: animação dos elétrons ao redor do núcleo, com explicação de forças de van der Walls (no meu canal) >>.
Abaixo um snapshot desse vídeo, mostrando distribuição heterogênea de elétrons ao redor do núcleo.
Essa fração de carga elétrica que se observa é representada pela letra grega delta minúscula: δ .

Imagem esxtraída de animação sobre força de van der Walls
Se essa molécula se aproxima de outra, a pequena carga negativa vai repelir os elétrons da outra e portanto criar uma pequena carga positiva na região mais próxima.. Desta forma as moléculas se atraem, pois em eletrostática (estudado em física) negativo atrai positivo.
Essa força existe entre todas as moléculas e átomos (no caso dos gases nobres que não formam moléculas e existem como gás monoatômicos).
Quanto mais elétrons estiverem presentes , mais forte será a força de van der Walls. Por isso que os pontos de ebulição dos halogênios, ou dos gases nobres, por exemplo, aumentam conforme o tamanho dos átomos aumenta (de cima para baixo na tabela periódica).
Com os alcanos acontece o mesmo: mais longa a molécula, mais elétrons presentes, mais alto o ponto de ebulição. Os alcanos pequenos (metano,propano) são gases, enquanto os de tamanho intermediário (hexano) são líquidos e os mais longos (parafina ) são sólidos. Polietileno é um polímero saturado de cadeia longa e portanto com propriedades semelhantes às da parafina.
Em uma vela observa-se a parafina nos 3 estados: sólido, líquido e gás. Revisar estados da matéria>> O grande cientista Michael Faraday escreveu um livro inteiro sobre a vela, descrevendo diversas experiências, e é uma obra que inspirou muita gente a se tornar cientista.
Força dipolo-dipolo
Algumas moléculas possuem a nuvem de elétrons permanentemente deformada, ou seja, que os elétrons estão sempre mais próximo de um átomo que do(s) outro(s). Dizemos que elas possuem um dipolo permanente (dipolo quer dizer um polo positivo e um negativo) e são chamadas de moléculas polares. Revisar moléculas polares e eletronegatividade>>
Isso ocorre porque certos elementos são mais eletronegativos que outros, quer dizer , eles têm mais tendência a puxar os elétrons . Nesse caso a deformação é maior, e é permanente, portanto essa força é maior que a de van der Walls.
Ponte de hidrogênio (hydrogen bond)
Ela é um caso especial da ligação dipolo-dipolo, descrita acima, onde há átomos os de O, F ou N ligados a hidrogênio. Isso inclui, portanto, a água. As pontes de hidrogênio são responsáveis por características importantes da água, como a tensão superficial que decorre da atração mútua das moléculas.
É a força intermolecular mais forte. Em inglês se pode escrever the strongest intermolecular force mas a força mais forte fica meio estranho, né? Podemos dizer que é a força mais intensa heheh. Mas em todo caso ela é muito mais fraca que uma ligação covalente (cerca de 20 x mais fraca).
Link biologia: Pense que a forte atração entre moléculas de água é o que permite formar a "coluna de água" no interior de uma árvore, que é um dos fatores que permite que a água suba das raízes até as folhas mais altas. Além disso, as pontes de hidrogênio conferem estrutura tridimensional às proteínas, o que é crucial para o funcionamento biológico delas, e também estruturam a dupla hélice do DNA. Abaixo uma ilustração das pontes de hidrogênio entre as bases citosina e guanina, lembrando que C sempre se liga a G e A a se liga a T. Isto é essencial para o poder do DNA the se replicar e propagar informação, e deve-se Às pontes de hidrogênio:
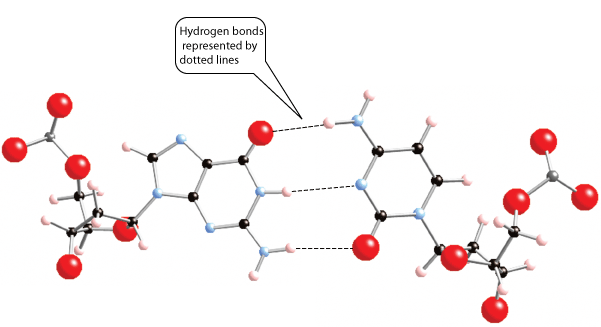
Linhas pontilhadas representam pontes de hidrogênio entre as bases do DNA, citosina e guanina. Oxigênio em vermelho, nitrogênio em azel, carbono em preto e hidrogênio branco.
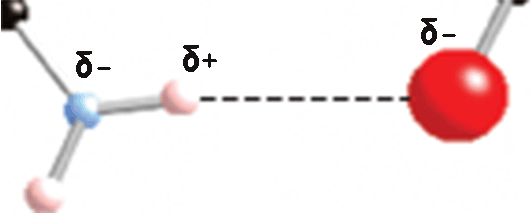
Detalhe de ponte de hidrogênio entre C e G, mostrando cargas parciais
O gelo, abaixo, é uma estrutura dominada por pontes de hidrogênio. Perceba como elas fazem com que as moléculas se orientem de acordo, o que causa um aumento das distâncias entre elas. Por isso o gelo é menos denso que a água, de modo que é uma pedra que flutua.
Outro efeito curioso do gelo é que ele funde (derrete) quando é aplicada pressão, o que tende a aproximar as moléculas a distâncias mais próximas do estado líquido. Por isso que o gelo é tão escorregadio, quando pisamos nele. Este efeito é explorado na patinação no gelo, onde se desliza muito bem, sobre uma lamina que concentra a pressão em apenas uma linha (quanto menor a área de contato, maior a pressão, para um mesmo peso).
Pontes de hidrogênio na estrutura do gelo - Veja como o hidrogênio (com carga parcial positiva) se alinha com o oxigênio (com carga parcial negativa):
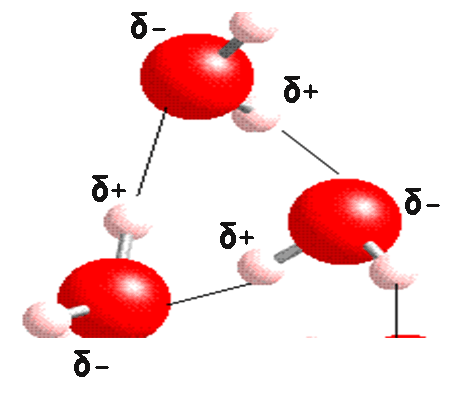
Detalhe de ponte de hidrogênio na estrutura do gelo (acima) mostrando cargas parciais
Da mesma forma as moléculas de água se orientam ao redor de íons em solução, como explicado aqui.
Pontes de hidrogênio atuam também entre moléculas de álcool: o ponto de ebulição do etanol é 352K e o do propano, um hidrocarboneto de massa similar é 294K .
As pontes de hidrogênio conferem à água propriedades muito especiais. Além daquelkas comuns às substÂncias polares (revisar aqui) ela apresenta uma alta tensão superficial.
Tensão superficial
As pontes de hidrogênio causam coesão das moléculas de água (umas atraem as outras) o que eresulta em um efeito chamado tensão superficial. Gotas separadas tendem a se juntar, e de prefrência em uma forma esférica. Dessa forma a área de superfície é reduzida ao máximo e as moléculas estão o mais próximas possível umas da soutras.
Vemos abaixo gotas de água sobre a superfície da folha do inhame. A gota pequena é quase uma esfera perfeita, mas a maior (abaixo) é mais deformada por causa da força da gravidade.


As imagens acima foram extraídas do meu vídeo:
A tensão superficial também possibilita que certos insetos caminhem sobre a superfície da água.
© Ricardo Esplugas de Oliveira, 2020
