Química > Básica > A ligação entre átomos, ideia central da química
O que é a química? É o estudo da matéria e suas transformações. Um entendimento dessas transformações nos permite construir as moléculas que nos interessam , sejam elas medicamentos, alimentos, tintas, cosméticos,plásticos, metais, nanotubos, etc.... Lembremos também da bioquímica, que é a química da vida!
Ligação química
A ideia mais importante da química é a de ligação química. Esta é que permite que os diferentes átomos se juntem (liguem) para formar as diversas moléculas e compostos que conhecemos. Se os átomos não se ligassem haveria apenas gases no universo…
Dessa forma pode-se construir as coisas mais variadas, inclusive a vida. A química da vida será estudada na seção de bioquímica, onde se estudarão as reações que são a essência da vida e o objetivo final, que é a transmissão da molécula de DNA para futuras gerações, de modo que essa seja perpetuada e constantemente aprimorada por meio da seleção natural.
Ainda mais interessante é o fato que substâncias podem se transformar em outras, por meio de um rearranjo de seus átomos, podendo incluir a adição de outros. Isto é o que se chama uma reação (ou transformação) química.
Interessa saber as regras segundo as quais os elementos se combinam. Por exemplo, porque existe o H2O mas não o H4O ou H5O? Porque o oxigênio forma moléculas de O2 e não de O4? E porque ele não anda sozinho, na forma de O como os gases nobres, que não são ativos quimicamente, ou seja, que não se combinam com outros (salvo em raras exceções)? Necessitamos conhecer estas regras para podermos construir as coisas que nos interessam. Antes, é bom dar uma revisada na estrutura do átomo.
O homem pré-histórico apenas usava osso, madeira e pedras. A conquista do fogo lhe permitiu fazer várias reações químicas novos, o que levou à descoberta das cerâmicas e depois dos metais. A habilidade de usar materiais mais sofisticados afeta muito a vida dos humanos, ao ponto de as eras se chamarem idade da pedra, idade do cobre, bronze, do ferro, etc. Tribos que não possuíam a tecnologia mais recente de fabricar objetos de metal eram dizimadas na guerra, pelas que possuíam os metais mais duros e resistentes..
Na nave Enterprise, da série Jornada nas estrelas (Star trek), há uma aparelho que se chama replicator e que permite criar alimentos, peças para a nave, roupas, qualquer coisa... O aparelho, que tem a aparência de um forno de micro-ondas, é capaz de montar os materiais que desejamos a partir dos átomos e de moléculas mais simples. Não é fantástico? Isso é impossível, atualmente, mas um dia poderá acontecer. De todas formas, o nosso conhecimento de química já nos permite produzir muitas coisas úteis. Estudaremos como que os átomos se juntam para formar coisas mais complicadas, e como estas se transformam em outras.
Regras de formação de ligações químicas
A química depende de quantos elétrons existem na última órbita (ou camada) de um átomo. Estes são os que valem! Por isso são chamados elétrons de valência, ou camada de valência. A química do elemento depende basicamente dos elétrons de valência. elementos em um mesmo grupo de tabela periódica possuem características químicas semelhantes porque possuem o mesmo número de elétrons de valência.
Regra do octeto
Observa-se que os átomos são mais estáveis com 8 elétrons na última camada (ou 2 no caso dos átomos menores). Quer dizer, eles são mais “felizes” assim(na prática trata-se de minimização de energia potencial, assim como uma pedra cai porque sua energia potencial é menor no chão). Se diz nesse caso que a camada de valência está completa.
Os gases nobres, que ocupam o último grupo (coluna) da tabela periódica, possuem suas camadas de valência todas completas. Por isso eles são muito estáveis e são felizes sozinhos. Por isso são chamados de nobres: eles não participam de reações com o resto dos átomos (existem algumas poucas exceções que foram descobertas no século XX).
Todos os outros átomos da tabela possuem camadas de valência incompletas e portanto querem fazer ligações com outros átomos (iguais ou diferentes) para que possam emprestar ou roubar os elétrons que lhe faltam para completar os 8 elétrons externos.
Alguns elementos tem uma tendência mais forte para doar elétrons, e por isso são mais reativos. Esta tendência é medida em volts (sim como em eletricidade, afinal são os mesmo elétrons, em química e física) e existe uma tabela chamada série eletroquímica.
Por exemplo, o sódio (Na) é muito reativo, ele quer desesperadamente dar um elétron, ao ponto de reagir com a água! Esta interessante reação é vista em muitos vídeos no youtube (eu não fiz aqui para você porque o sódio custa muito caro...). Se invés de sódio for usado outro metal alcalino uma chama é produzida espontânea mente, pois quanto maior o metal alcalino (mais pra baixo no grupo da tabela periódica), maior a reatividade.
Considerações energéticas
A formação ou quebra de ligações químicas (e portanto de elementos e compostos) envolve a liberação ou consumo de energia, respectivamente e isto será estudado em detalhe. Reações químicas que liberam muita energia incluem as que envolvem os combustíveis (fuels).
Os sistemas físicos e químicos buscam sempre um estado de mínima energia potencial, assim como a pedra que cai vai até o ponto mais baixo que possa chegar.
O octeto descrito acima contribui para uma situação de mínima energia mas não é o único fator.
O fator que determina que uma reação química de fato ocorre é a energia livre de Gibbs: quanto menor esta, mais estável o composto, como veremos em detalhe aqui.
Tipos de Ligações químicas: iônicas, covalentes e metálicas
-Ligações iônicas : Nesta ligação são formados íons, quer dizer, átomos que perderam ou ganharam elétrons. Íons têm carga elétrica e portanto estão sujeitos a forças elétricas de atração e repulsão. Esta atração é que é responsável pela ligação.
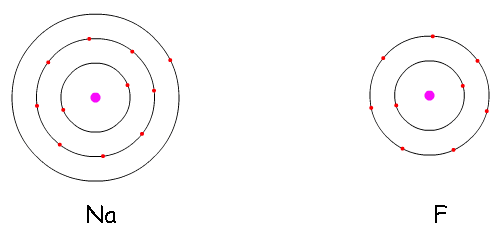
átomos de Na e F, destacando suas camadas eletrônicas
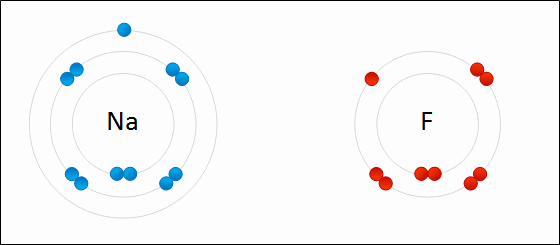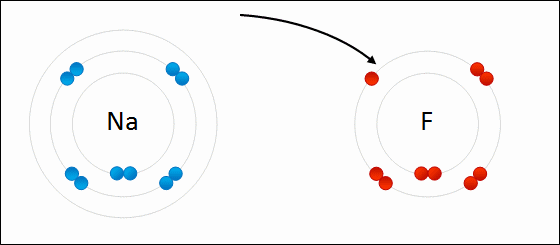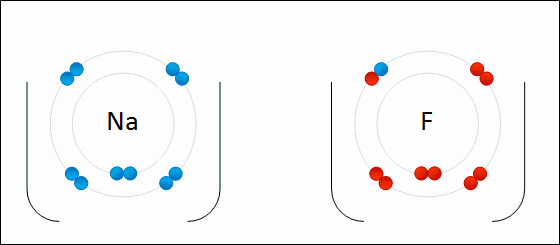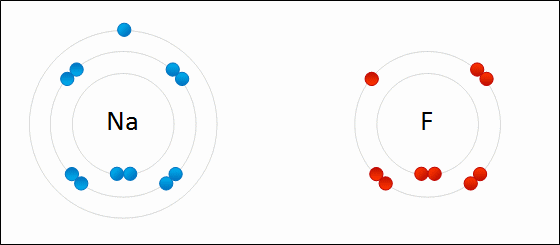
Animação da formação de ligação iônica entre sódio e flúor. Crédito Wokipedia, Wdcf
Nas imagens acima vemos o sódio e o flúor. O sódio tem muita vontade de dar o elétron que está sozinho na última camada e o flúor quer receber mais um elétron para completar sua última camada que tem 7 elétrons. O objetivo das ligações químicas é completar a camada de valência com 8 elétrons.
Dessa forma o sódio que perdeu elétron torna-se positivo (Na+) e o flúor que ganhou torna-se negativo (F-). Ambos se atraem pela força elétrica. Trilhões de íons de Na e F formam um cristal, pois as atrações entre Na+ e F- predominam sobre as repulsões entre Na+ e Na+ e entre F- e F-.
A ligação iônica costuma formar cristais, que são conjuntos de átomos ligados de maneira altamente ordenada. Veja o exemplo do cristal de Na Cl abaixo, onde o Cl que ganhou elétrons é maior do que o Na que perdeu::
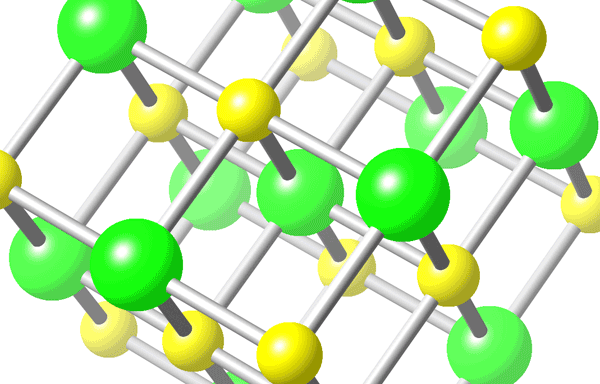
Estrutura do NaCl - Cl em verde e Na em amarelo
-Ligações covalentes :
Neste caso não há transferência de elétron de um átomo a outro. Invés disso, há um compartilhamento.
Imagine que o átomo de flúor (acima) queira se unir a ele mesmo, para formar a molécula de F2. Ambos átomos querem receber 1 elétron , mas nenhum deles quer dar. Nesse caso eles devem compartilhar 1 elétron, para que ambos desfrutem dos 8 elétrons na camada de valência. Este compartilhamento é representado por um traço entre os elementos: F-F.
Os compostos que possuem ligações covalentes são chamados de moléculas, como a sacarose abaixo:
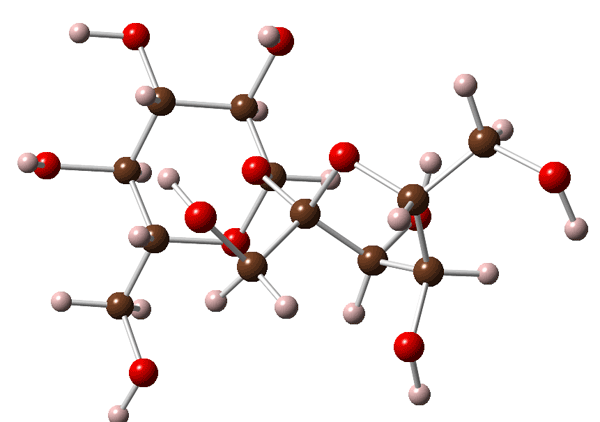
Fórmula estrutural da sacarose
A sacarose pode também formar cristais, assim como a água que é outra moléculas, pode também formar cristais, mas isso envolve outras forças , que são as forças intermoleculares (entre moléculas).
Perceba que a ligação iônica não é responsável apenas pela ligação de um par de íons, mas de todo o cristal. Por isso ela é também considerada uma força intermolecular.
-Ligações metálicas :
Estas ligações ocorrem entre átomos de metais, formando um material que é muito útil, também chamado de metal.
É uma ligação que une muitos átomos iguais com geometrias (estruturas cristalinas ) que dependem dos átomos envolvidos. Esta estrutura é caracterizada pelo "mar de elétrons". Os núcleos dos átomos permanecem em posições fixas enquanto os elétrons de valência ficam livres para se movimentar por outros átomos. Esta liberada dos eletros é responsável pelas altas condutibilidades elétrica e térmica dos metais. Bastante fornecer uma diferença de potencial elétrico ou de temperatura que os elétrons começam a se movimentar em conjunto, de forma ordenada. A imagem abaixo ilustra o mar de elétrons:
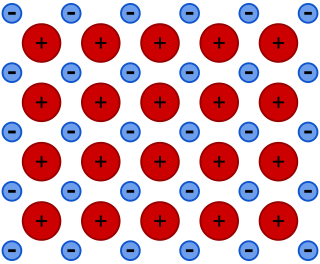
Modelo de ligação metálica
Os elétrons neutralizam a repulsão eletrostática entre os núcleos e o efeito total é atrativo.
Elementos que possuem poucos elétrons de valência forman ligações metálicas fracas, pois estes são os responsáveis pela ligação. O sódio por exemplo, que possui apenas 1 elétron de valência, é mole, e pode até ser cortado com uma faca.
Muitas propriedades de metais podem ser explicadas por este modelo do mar de elétrons, como veremos em detalhe.
