Química > Eletroquímica > introdução : a química e a eletricidade juntas!
A eletricidade pode fazer acontecer uma reação química (1) e também uma reação química pode produzir eletricidade (2), que é o que acontece nas pilhas e baterias. Veremos exemplos de ambos os casos.
A fabricação de baterias é um dos grandes desafios da atualidade, para permitir o uso extensivo de carros elétricos e reduzir a poluição causada pelo petróleo e seus derivados. Imagine que se não existissem baterias não teríamos telefones celulares! E os carros teriam que ser empurrados toda vez que tivessem que ser ligados (ou usar uma manivela como antigamente).
E´ um capítulo interessante porque une a química e a física, e portanto pertence à físico-química.
A química estuda como os átomos se combinam para formar moléculas. Cada átomo é cercado de elétrons e estes é que fazem a ligação. Portanto não deve ser uma surpresa o fato que a eletricidade ( o estudo dos elétrons) está relacionada à química.
1)A eletricidade fazendo a reação química acontecer
Como já sabemos, uma reação química acontece quando ligações químicas se rompem e outras se formam. Quando ligações são muito fortes para serem quebradas, a eletricidade pode dar uma ajudinha.
Exemplo: Como quebrar uma molécula de água?
A molécula de água é muito estável (é difícil de quebrá-la). Não existe vida (como conhecemos) sem água líquida, e se ela se quebrasse com facilidade teríamos um grande problema, ou melhor, não existiríamos.
Usando condições mais extremas, pode-se quebrar a molécula de água. Há 3 situações:
a) Reação química inorgânica: pode-se usar um elemento altamente reativo, como um dos metais alcalinos (os situados no primeiro grupo -ou coluna - da tabela periódica). Estes são tão reativos que dificilmente são observados por aí. Eles devem ser guardados dentro de óleo porque até a água presente no ar seria suficiente para reagir com eles. Se um pedaço de potássio é jogado na água, uma chama roxa é produzida. O potássio quebra a molécula de água e libera o gás hidrogênio que é inflamável. O calor da reação causa a ignição. É curioso o fato de que os metais alcalinos são moles e podem ser cortados com uma faca. Tudo isto pode ser visto no vídeo abaixo:
Outro exemplo importante do uso da eletricidade para promover reações químicas é o do refino do alumínio.
b) reação química orgânica: os organismos vivos executam milhares de reações químicas, e muitas delas nós ainda não conseguimos reproduzir em laboratório. A bioquímica usa enzimas especializadas para cada reação. A quebra da água é executada por plantas e algas no processo de fotossíntese, sendo os hidrogênios usados para construir moléculas e o oxigênio liberado como gás.
c) Eletrólise - significa a eletricidade (eletro) fazendo a quebra (lise) .
Muitas substâncias diferentes podem sofre eletrólise, incluindo a água.
O resultado da quebra da água são os gases hidrogênio e oxigênio.
Perceba que para a eletrólise,energia elétrica deve ser fornecida externamente, para forçar a reação. O oposto ocorre no caso da pilha ou bateria, em que a energia elétrica é produzida pela reação, que ocorre de forma espontânea (mais detalhes abaixo).
Como vimos, um elemento é reativo porque quer dar eletrons. Esta vontade de dar pode ser quantificada, e a grandeza se chama potencial de eletrodo . É também chamado de potencial de redução porque reduzir um elemento significa dar elétrons a este elemento. Há alguns exemplos abaixo, aqui e uma tabela mais completa pode ser vista aqui.
| Eo | ||||
| Li++ e− | ⇌ | Li(s) | -3,04 | |
| K++ e− | ⇌ | K(s) | −2,90 | |
| Zn2++ 2 e− | ⇌ | Zn(s) | −0,76 | |
| Co2++ 2 e− | ⇌ | Cu(s) | -0.28 | |
| Cu2++ 2 e− | ⇌ | Cu(s) | +0,34 |
Potenciais de eletrodo - Lista mais completa aqui
Quanto mais negativo o número, maior a vontade de dar elétrons e mais reativo o elemento (ou substância). Os que possuem valores positivos são aqueles que preferem receber do que dar. O hidrogênio foi escolhido como o zero (arbitrariamente), e todos os outros são medidos com relação ao hidrogênio.
Por exemplo,no exemplo acima, o potássio tem um potencial de eletrodo muito negativo (-2,9) e por isso consegue dar elétrons pra água, quebrando-a.
2) A reação química produzindo eletricidade
A bateria
Se juntarmos 2 elementos, sendo um que quer dar e outro que quer receber, por exemplo, elétrons passarão de um ao outro e portanto teremos uma corrente elétrica, ou seja, eletricidade! O processo é espontâneo.
A voltagem da bateria será a soma dos potenciais de eletrodo (tabela) dos elementos envolvidos. Vamos considerar dois casos:
-No caso de um quer dar e o outro quer receber
Zn e Cu
O zinco é um metal reativo e pretende dar elétrons. O cobre tem a tendência de receber, invés de dar. Portanto, elétrons fluirão do zinco ao cobre. Eles constituem uma célula química, que é a base das bateria. A bateria pode ter várias células como esta.
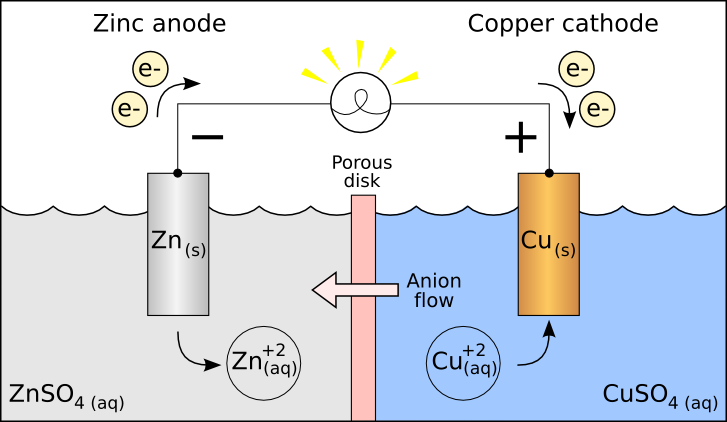
célula química Zn-Cu (imagem da Wikipedia)
A voltagem da célula será a soma da vontade de dar do Zn (0,76) com a vontade de receber do cobre (0,34):
E = 0,34 + 0,76 = 1,1 V
-Caso em que ambos querem dar, mas um deles quer mais
E se usarmos Zn e Co. O cobalto também quer dar, mas como o Zn quer mais, o Zn vai dar pro cobalto. A voltagem será a vontade de dar do Zn menos a vontade de dar do cobalto:
E = 0,76 - 0,28 = 0,48
Veja que o lítio, por exemplo, tem muita vontade de dar (3,04) e portanto é muito bom para baterias. Ele é muito usado em baterias de celulares e notebooks.
Próximo - Oxidação e redução >>
