Química > Físico-química > Entalpia > o que é entalpia? Qual a diferença entre entalpia e energia?
Utilize a minha calculador de entalpia de combustão>>
O que é entalpia?
Para os cálculos de química a nível ENEM, entalpia pode ser considerada o mesmo que energia(em química a nível terceiro grau, existem situações em que entalpia difere de energia). Ambas entalpia e energia são medidas em joules (J) , mas entalpia é usada apenas em química, no conceito de energia das ligações químicas e da energia liberada ou consumida em uma reação química. Um dos métodos explicados aqui é justamente para calcular uma entalpia de reação com base nas entalpias das ligações químicas que são quebradas e feitas.
Um exemplo de energia liberada em uma reação química seria a queima de um combustível qualquer. Uma reação endotérmica é um pouco mais difícil de imaginar. Vou dar o exemplo daquela que é talvez a mais importante de todas: a fotosíntese. A energia necessária para produzir a glicose a partir do gás carbônico é fornecida pelo Sol, na forma de luz. A reação inversa À fotosíntese, que seria a oxidação da glicose nas células vivas, que é o processo pelo qual obtemos energia para viver, é uma reação exotérmica, cujo entalpia é calculada aqui.
Entalpia de formação (ou entalpia padrão de formação) - ΔHf
Esta é a entalpia do processo de formação de uma determinada substância, a partir de elementos em suas formas mais estáveis , sob pressão atmosférica. Como comentei antes, trata-se de energia e portanto é medida em J. Normalmente usa-se kJ/mol ou kcal/mol. A caloria é uma unidade mais usada pelos químicos, mas a unidade oficial, no SI (sistema internacional) é o J.
Exemplo: CO2
O oxigênio, sob pressão atmosférica, encontra-se sob a forma de gás. O carbono encontra-se sob a forma de sólido. A entalpia de formação do CO2 é a entalpia da reação abaixo:
C + O2 → CO2
A entalpia de formação é quase sempre negativa (processo exotérmico), mas há alguns casos em que é positiva. Como explicado aqui, isso vai depender da entalpia das ligações quebradas e formadas na reação.
Exemplo: Alumínio como combustível do ônibus espacial
O óxido de alumínio, resultado da mistura de alumínio metal e oxigênio, tem uma alta entalpia de formação ΔHf = -1674.1 kJ/mol e portanto libera muita energia. Ele é usado no combustível sólido do ônibus espacial.
4 Al +3 O2 → 2Al2O3
Tabela de entalpias de formação (o f subscrito após ΔH indica formação)
| Composto | ΔHf (kJ / mol) |
| CaCO3 | −1206.9 |
| CaCl2 | −795.8 |
| MgCO3 | −1095.797 |
| MgCl2 | −641.8 |
| Mg(OH)2 | −924.54 |
| Mg(OH)2 | −926.8 |
| MgO | −601.6 |
| HgO | −90.83 |
| HgS | −58.2 |
dados da Wikipedia. A tabela completa pode ser vista aqui.
Entalpias são calculadas para diversos tipos de reações químicas
Acima dei o exemplo da entalpia de formação, que é aquela envolvida na reação de formar uma dada substância. Em seguida considero a entalia de combustão:
Entalpia de combustão
Esta é relativa à queima de substâncias, e portanto à reação com oxigênio.
Por exemplo a entalpia de combustão do metano , representada na reação abaixo. é ΔH = −891 kJ/mol).
CH4 + 2 O2 → CO2 + 2 H2O
O metano é usado como combustível em turbinas a gas e também nos foguetes da empresa SpaceX, que o utilizam em combinação como o oxigênio líquido. O uso do oxigênio puro oferece uma reação muito mais eficiente do que com o oxigênio do ar apenas (pois 80% do ar consiste de nitrogênio, e apenas 20% é oxigênio).

Turbina a gás (crédito: U.S. National Archives)
A entalpia de formação de óxidos é igual à entalpia de combustão, pois ambas são uma reação com oxigênio. Portanto a entalpia de formação do Al2O3 é igual à entalpia de combustão do Al. A tabela abaixo inclui outros exemplos de entalpias de formação que são também entalpias de combustão:
| Composto | ΔHf (kJ / mol) |
| Al203 | -1674.1 |
| B2O3 | -1271.5 |
| Cr2O3 | -1138.6 |
| MgO | -601.1 |
| NaO | -413.8 |
Entalpia reticular (de um cristal) ou entalpia de cristalização ou entalpia de rede (lattice enthalpy)
Esta é a energia liberada poe íons que se unem formando um cristal.
Por exemplo, o processo abaixo é observado na formação do sal de cozinha:
- Na+ (g) + Cl− (g) → NaCl (s)
A entalpia deste processo é -786 kJ/mol.
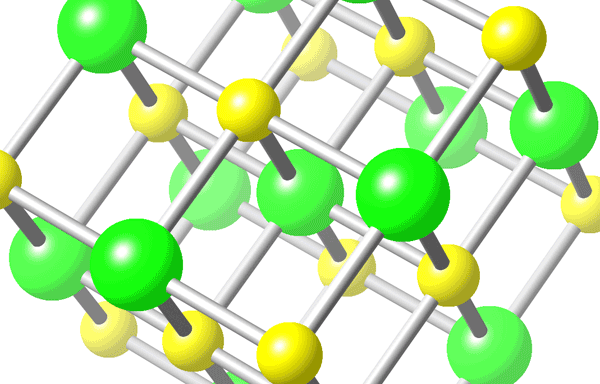
Cristal de NaCl com Cl em verde e Na em amarelo
Perceba que os íons estão no estado gasoso. Entalpias de cristalização para outros compostos são dadas na tabela abaixo:
| Composto | ΔHf (kJ / mol) |
| LiF | −1030 kJ/mol |
| NaCl | −786 kJ/mol |
| NaBr | −747 kJ/mol |
| NaI | −704 kJ/mol |
| CsCl | −657 kJ/mol |
Perceba que a energia de cristalização é maior no caso do LiF, porque átomos menores podem chegar mais perto e formar ligações mais fortes .
Perceba também que cristais com frequencia se formam apartir de um elemento dos 2 primeiros grupos da tabela periódica, com outro dos 2 últimos grupos à direita (sem considerar os gases nobre que sabemos não participam de ligações - com raras exceções).
As energias de rede podem ser calculadas usando o ciclo de Born-Haber
Entalpia de hidrogenação
Esta é a entalpia associada à reação com hidrogênio (H2 ). Vejamos o exemplo da reação de ciclohexeno com hidrogênio, cujo produto é o ciclohexano:

Perceba que o processo é exotérmico (sinal negativo). A ligação dupla desaparece e a molécula fica saturada.
No caso do benzeno, que tem 3 ligações duplas, se esperaria que a entalpia de hidrogenação fosse 3 vezes este valor, mas é muito menos. Isto deve-se à energia de ressonância.
Entalpia de solvatação
Essa é relacionada ao processo de dissolução de um soluto em um solvente. Por exemplo, dissolver sal na água. Nem todos concordam se isto é uma reação química ou não (ver por exemplo esta referência), mas o fato é que há interações entre os íons carregados e o solvente. No exemplo do sal na água, as moléculas de água (devido à polaridade delas - revisar ponte de hidrogênio) se orientarão com suas cargas parciais negativas voltadas para os íons positivos (e vice-versa para os negativos).
Essas interações entre o dipolo da água e íons em solução são muito mais fracas que as ligações covalentes, mas assim mesmo podem transferir energia.
A entalpia de solvatação é composta de 3 partes:
1) a quebra das ligações no sólido (soluto)- endotérmica
2) A quebra da interações entre as moléculas do solvente (por exemplo pontes de hidrogênio)- endotérmica
3) a interação entre moléculas do solvente e do soluto - exotérmica
Portanto a soma destas 3 etapas pode resultar numa solvatação exotérmica ou endotérmica. Por exemplo a diluição de soda cáustica em água produz um aumento grande de temperatura (exotérmica) , enquanto a diluição de bicarbonato de sódio em água causa uma diminuição da temperatura (endotérmica).Esta última pode ser feita na cozinha facilmente. E mesmo que não tiver termômetro, você pode sentir um esfriamento.
foto cobre 2+ com coordenação
© Ricardo Esplugas de Oliveira, 2020
