Química > Físico-química > Entalpia > Ciclo de Born-Haber
O diagrama mostra uma série de processos cujas energias se adicionam, seguindo a Lei de Hess
Conforme discutido na introdução da entalpia e energética química, os processos exotérmicos podem ser representados por setas apontando para baixo e os endotérmicos por setas apontando para cima, como no diagrama abaixo:
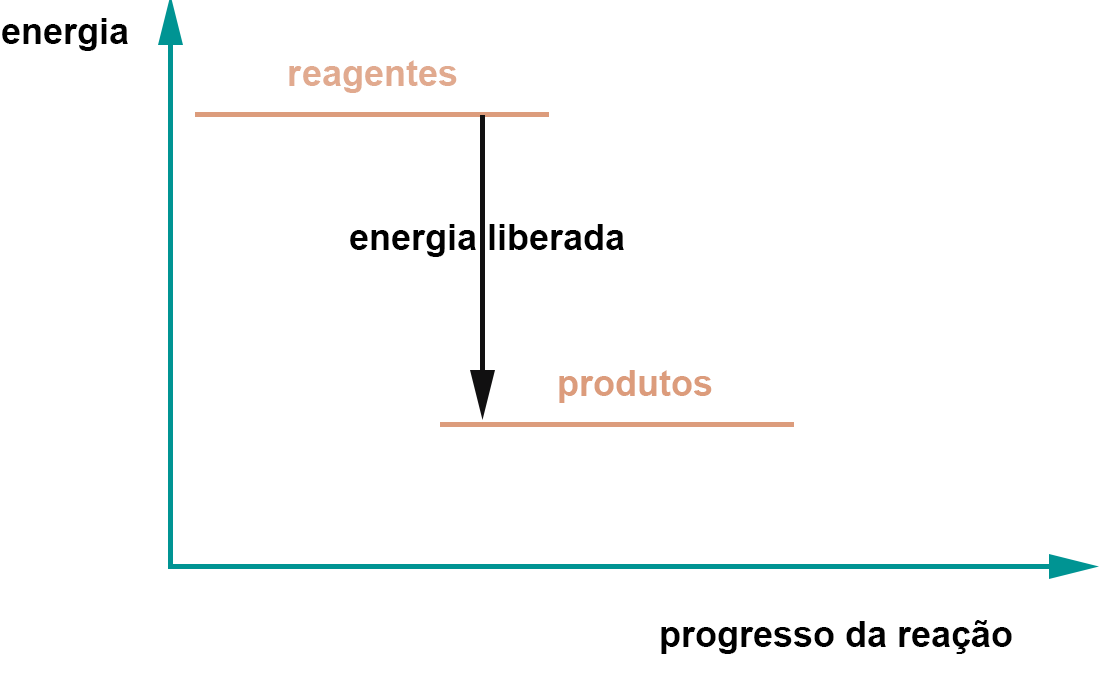
gráfico ilustrando uma reação exotérmica
O diagrama da questão da FUVEST 2007 é similar mas se vê um pouco mais de detalhes:
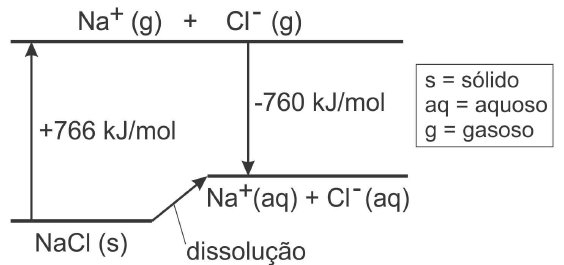
Questão FUVEST 2007
Normalmente , num diagrama do ciclo de Born-Haber, se vê ainda mais detalhes . Usaremos o exemplo da questão do ITA-2019 para ilustrar isso. O diagrama será construído passo a passo.
(ITA 2019): Considere as variações de entalpia de processo abaixo tabeladas
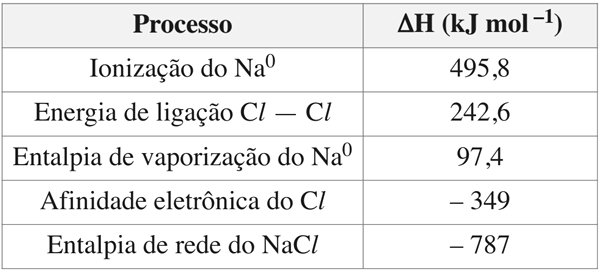
a) Esboce o diagrama de Born-Haber para a formação do NaCl(s) a partir de Na⁰(s) e Cl2(g) e calcule a variação de entalpia de formação do NaCl(s).
b) Sabe-se que o valor absoluto (em módulo) da entalpia de rede do CaO(s) é maior do que a do NaCl(s). Explique por quê.
Resolução:
a)
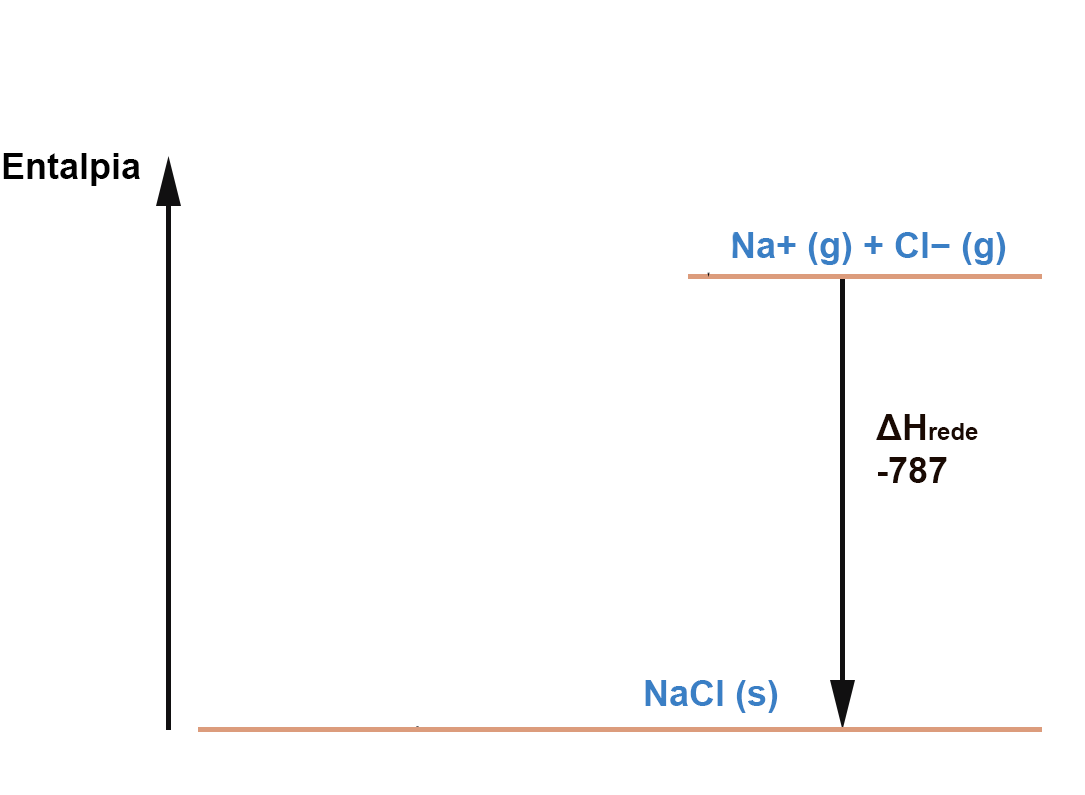
Vamos desenhar o diagrama de Born-Haber para o NaCl.
Primeiro, vamos representar a entalpia de rede (todas as entalpias são dadas em kJ). A entalpia de rede por definição é a diferença entre a entalpia dos íons no estado gasoso e mo estado cristalino. A formação do cristal (rede cristalina) é um processo exotérmico e por isso a seta aponta para baixo e o valor da entalpia é negativo:
Outro processo exotérmico, representado por uma seta para baixo, é a ionização do Cl(g):
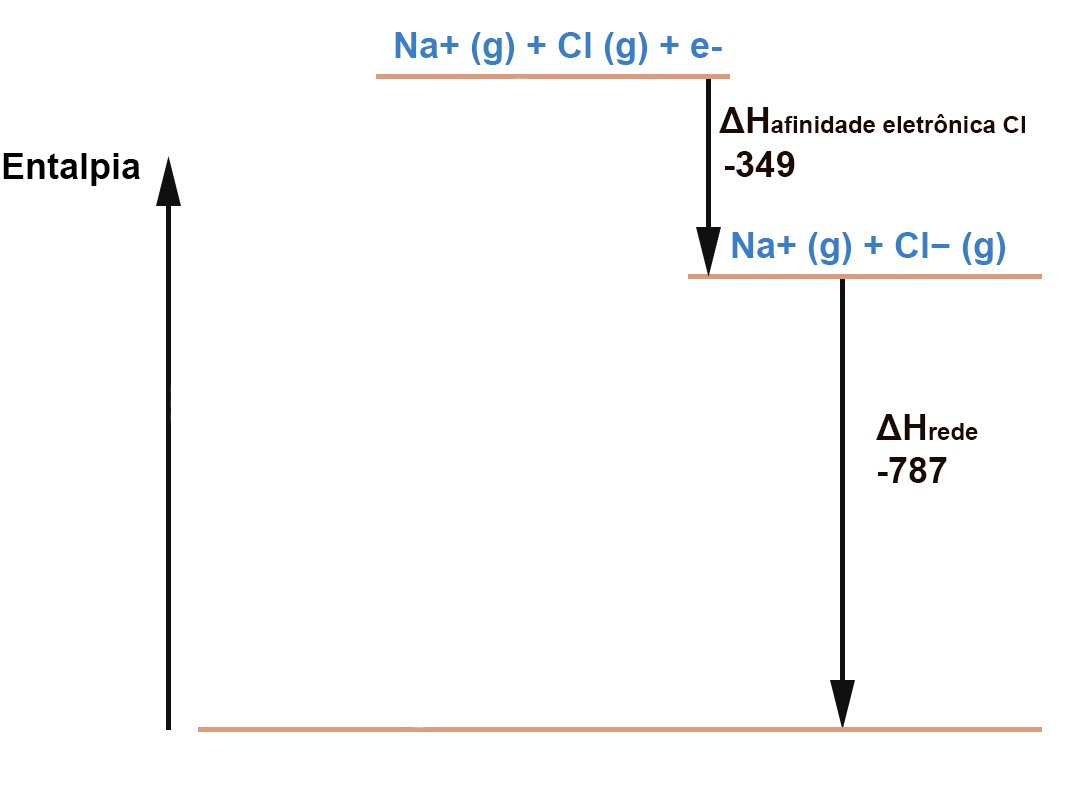
Agora vamos considerar os processos endotérmicos, representados por setas apontadas para cima.
A ionização do Na (remoção de 1 elétron) requer energia:
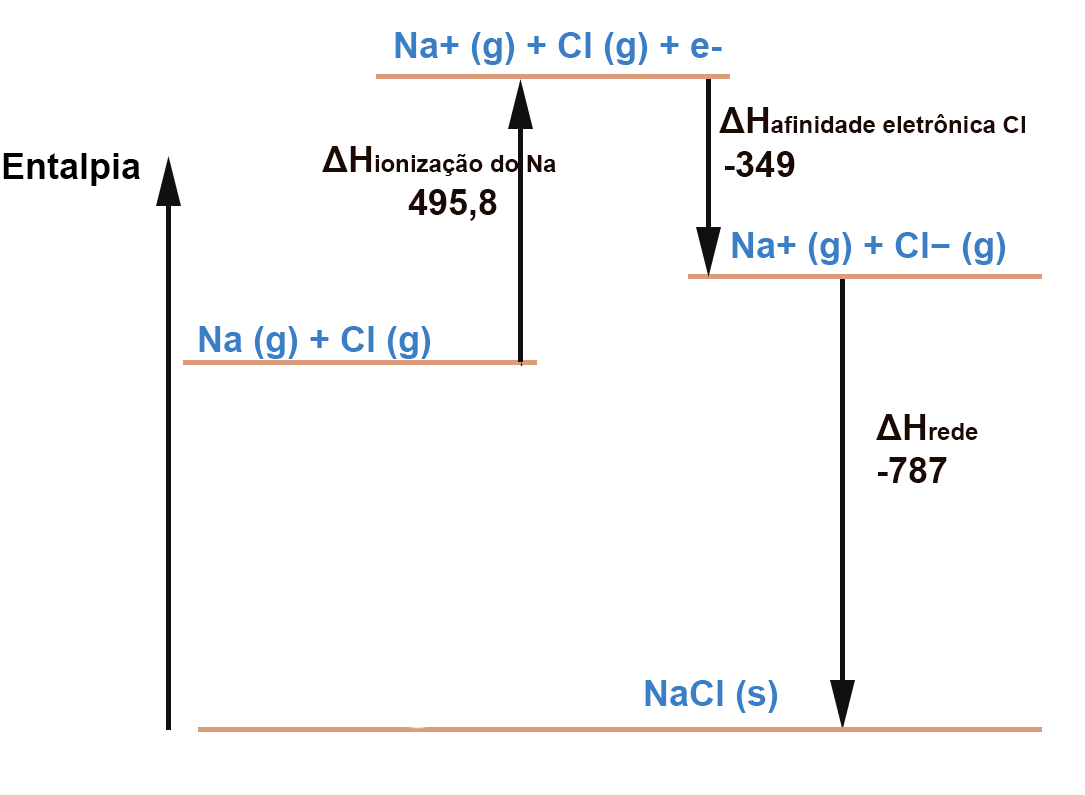
Outro processo endotérmico é a quebra da ligação Cl-Cl. O estado padrão do gás cloro é na forma de molécula diatômica (Cl2) . Apenas 1 átomo de cloro vai reagir co o NA para formar o NaCl e por isso a fração 1/2 em frente do Cl2. Note também que o valor dado na tabela para a dissociação do Cl2 é por mol (kJ/mol) e como usamos apenas 1/2 mol este valor é também cortado pela metade. Por isso usamos apenas 121,3 kJ:
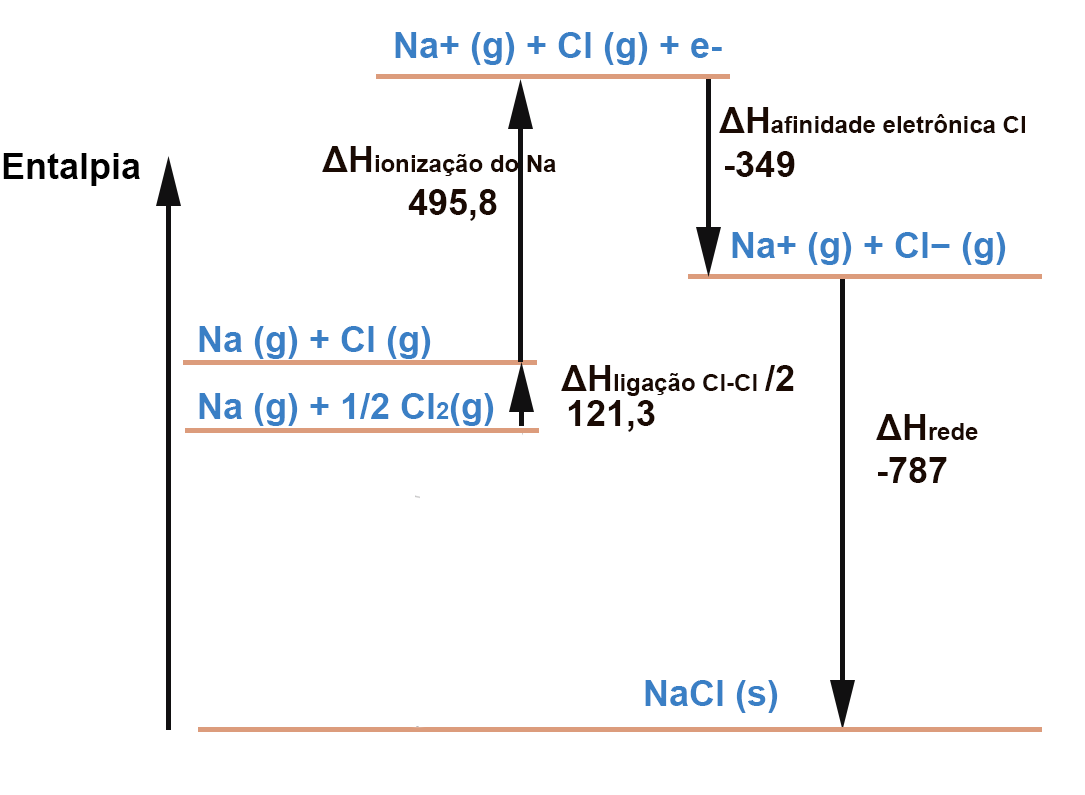
Outro processo endotérmico é a vaporização do Na, ou seja , a transformação Na(s) para Na(g):
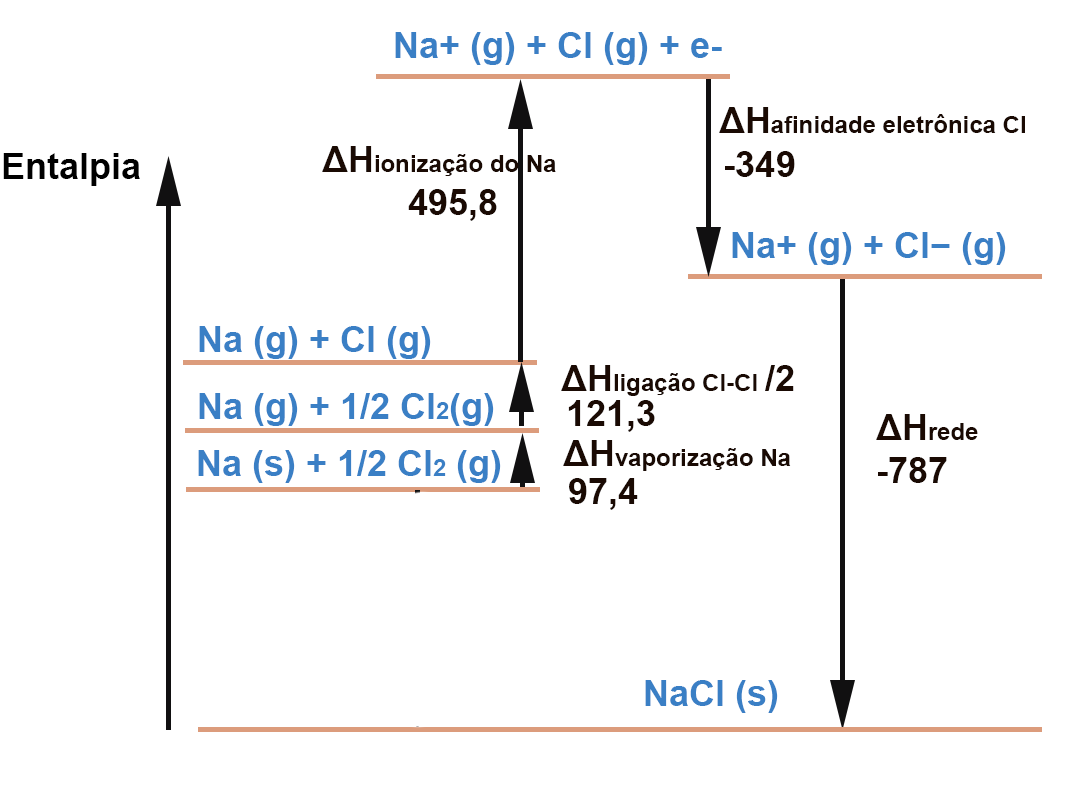
Agora todos os valores dados na tabela doe exercício já estão no diagrama. Nos falta calcular a entalpia de formação , que é a pergunta do exercício. Esta corresponde à formação do NaCl(s) a partir dos seus elementos constituintes, nos seus estados padrão, que são metal (sólido) para o sódio e gás molecular para o cloro. Isto é o que se observa na linha imediatamente acima do NaCl, do lado esquerdo do diagrama. Portanto a entalpia de formação é a última seta que desenharemos:
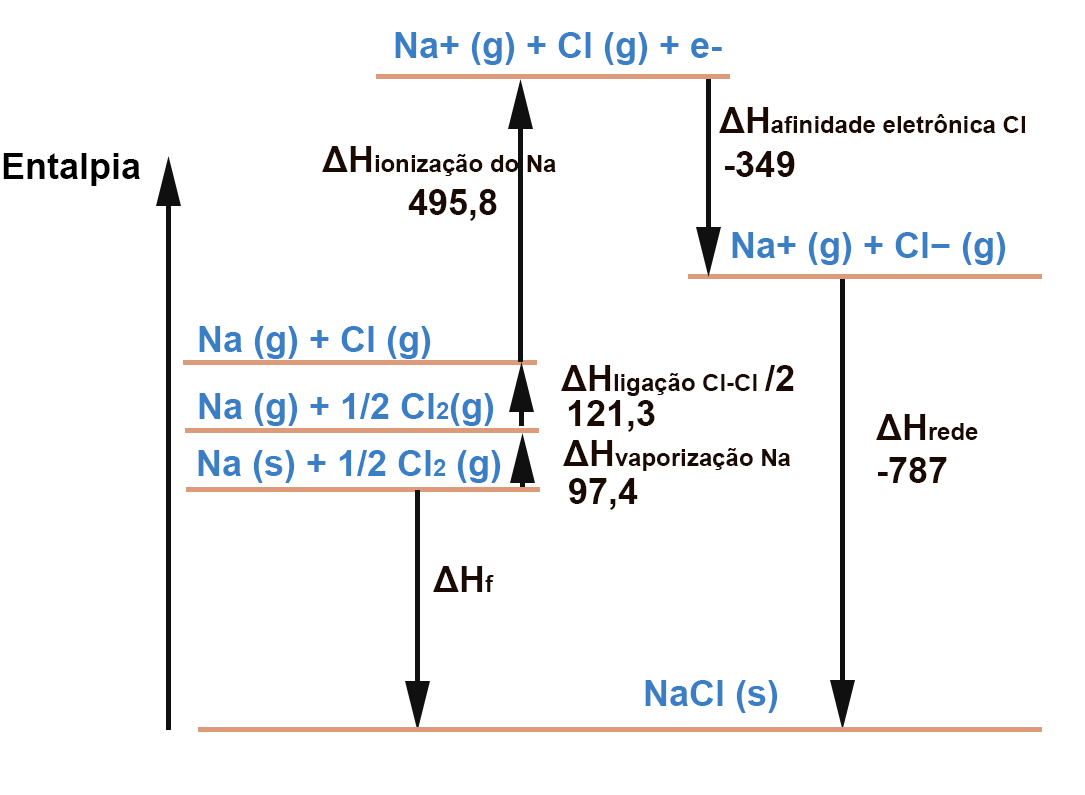
Para calcular o valor de ΔHf devemos apenas analisar o diagrama e fazer somas e subtrações. É um cálculo de Lei de Hess, como já foi mencionado.
A soma dos processos exotérmicos é -787-349 = -1136
A soma dos processos endotérmicos é 97,4+ 121,3+495,8 = 714,5
-1136 + 714,5 = -421.5
Portanto , ΔHf = -421.5 kJ / mol de NaCl(s)
b) No caso do CaO a energia de rede é maior porque os íons tem carga de valor 2 e portanto a atração é maior.
Como exemplo final, o ciclo de Born-Haber para o LiF:
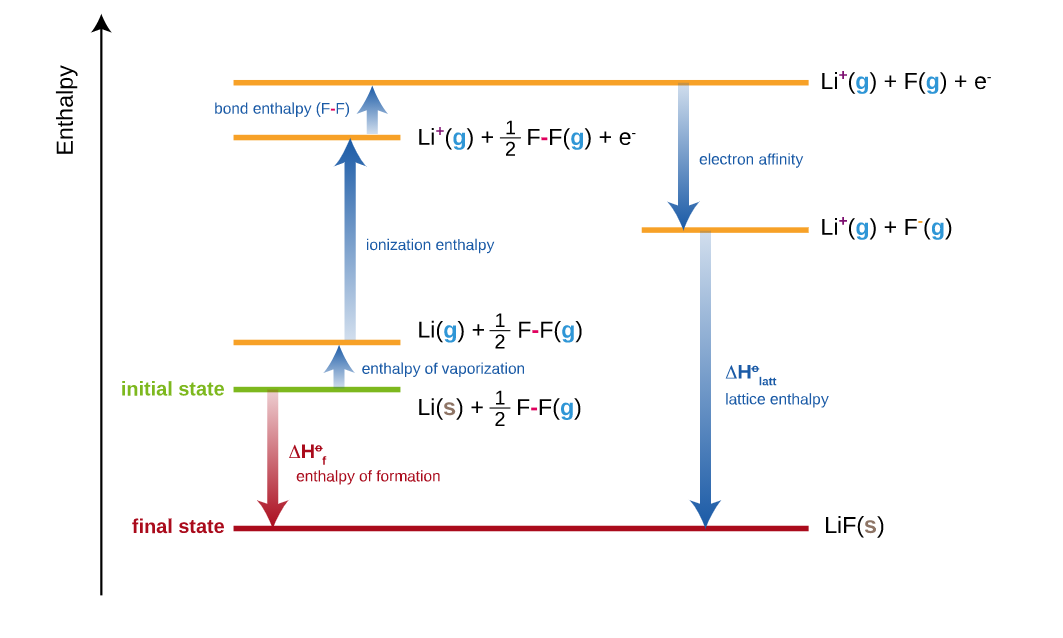
Ciclo de de Born-Haber para o LiF imagem: Wikipedia
© Ricardo Esplugas de Oliveira, 2021
