Química > no cotidiano > Água sanitária
A água sanitária é uma solução de hipoclorito de sódio em água. Esta é uma substância bastante reativa e bastante útil, em particular na esterilização (destruição de micróbios)
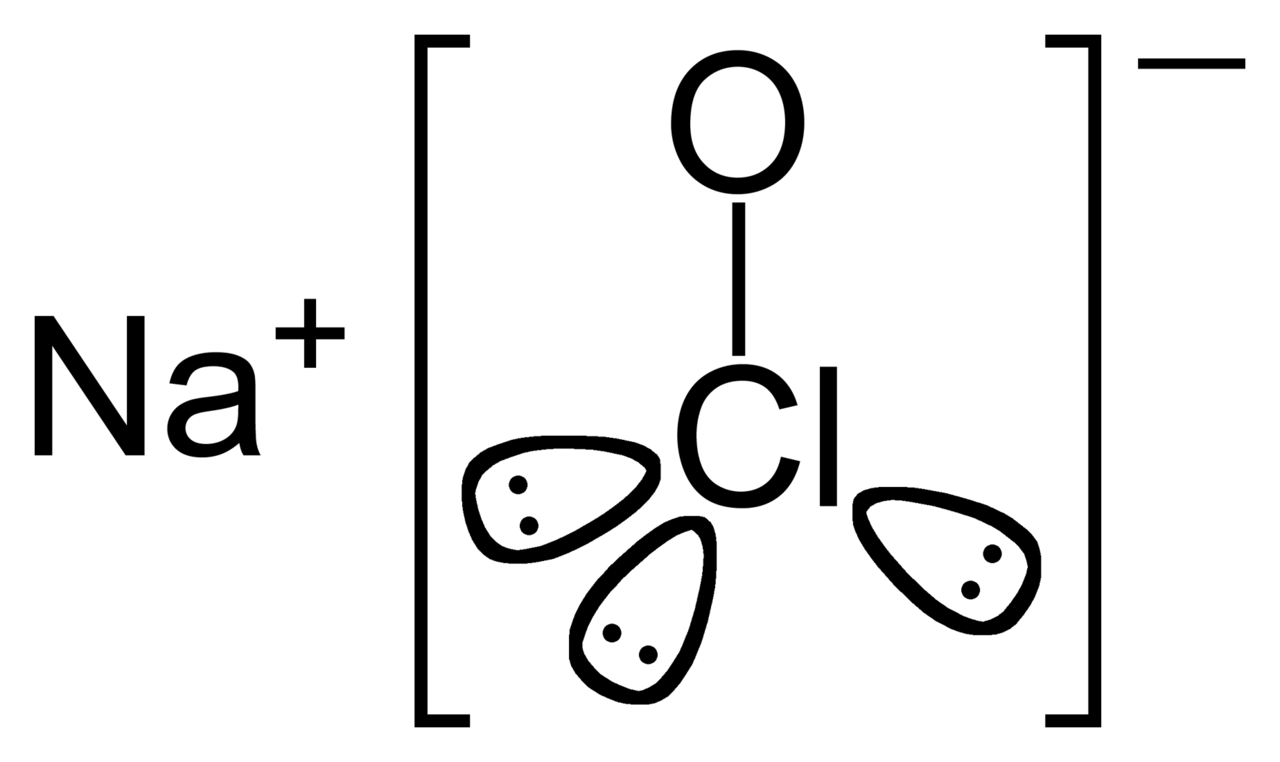
hipoclorito de sódio, mostrando os pares de elétrons isolados no Cl - Imagem: Wikipedia
Em inglês o efeito da água sanitária é chamado de bleaching. outras substâncias que funcionam como bleach, como a água oxigenada (hydrogen peroxide) mas a solução de hipoclorito de sódio é a mais comum, provavelmente por ser mais barata. Estas substâncias são altamente reativas. Mais especificamente, elas agem como oxidantes. Como toda substância reativa, ela pode ser destruída com facilidade e por isso ás soluções são fornecidas em recipientes não transparentes (para evitar reações causadas pela luz) e devem permanecer fechados.
Por ser um produto que pode causar sérios danos a saúde, e está presente em todos os lares, é necessário tomar muito cuidado, especialmente se há crianças no ambiente (estas podem beber o produto).
Usos
- Branqueamento
Usa-se para branquear diversos materiais, incluindo tecidos e papel. Para branquear partes do corpo humano, normalmente usa-se outra substância similar (bleach), como a água oxigenada. Esta é também um forte oxidante, e é mais conveniente para ser usada no branqueamento de cabelos e dentes.
No caso do descolorimento de cabelos, em particular, é perigoso usar o hipoclorito de sódio porque este reage com a amônia produzindo o cloro, na forma gasosa -Cl2 (g) -que é muito tóxico. Abaixo é mostrado o equilíbrio químico que produz o gás cloro.
-Como a água sanitária destrói as cores?
As moléculas que funcionam como pigmentos possuem a propriedade de absorver certas cores e refletir outras. Um pigmento azul, por exemplo, absorver todas as cores menos o azul que é refletido, e por isso vemos azul. Para que a molécula possa reagir com a luz dessa forma, é necessário que ela possua ligações duplas conjugadas. Pode ser uma longa estrutura conjugada como no caso do beta caroteno (explicado aqui) ou estruturas menores, quando há a presença de átomos de oxigênio e / ou nitrogênio na estrutura conjugada, como visto aqui no cado do pigmento índigo (usado em calças jeans - indigo blue).
As ligações duplas são ricas em elétrons e portanto reativas. A água sanitária oxida essas ligações duplas e acaba com o poder da moléculas de interagir com aluz. Dessa forma sua cor desaparece. As ligações duplas podem ser destruídas também pelos raios UV emitidos pelo sol, e por isso observamos que as cores vão enfraquecendo quando expostas ao sol por muito tempo.
-Limpeza e esterilização
Devido ao mesmo poder oxidante que causa branqueamento, o hipoclorito de sódio mata bactérias, vírus e fungos. Ele ataca as proteínas na superfície destes, causando no mínimo a destruição das estruturas tridimensionais destas, e portanto deixando-as sem funcionar. Esta propriedade é também a que determina seu uso em piscinas.
É importante notar que a água sanitária deve permanecer pelo menos 10 min em contato com a superfície a ser desinfetada.
- Efeito desodorante
Desodorante quer dizer remover odor. Recipientes de plástico, em particular, tendem a manter o aroma dos seus conteúdos mesmo após a lavagem com detergente e água. Isto é particularmente problemático co relação a peixes e frutos do mar, por exemplo. Se houver um enxague com hipoclorito de sódio todos os aromas desaparecem.
Para encerrar, devo dizer que existem muitas outras aplicações do hipoclorito de sódio . Como exemplo final citarei que é usado também para destruir armamentos químicos, ou seja, substâncias com alto poder letal.
Concentração da solução de hipoclorito de sódio
A água sanitária é uma solução de hipoclorito de sódio em água. Este é um sal branco, mas quando dissolvido em água causa uma coloração amarelada.
A água sanitária vendida em supermercados consiste de uma solução de 2 a 2,5% (massa) de concentração. Esta vem escrita no rótulo do produto. Em lojas especializadas pode-se conseguir concentrações maiores. Existe também uma concentração de aproximadamente 0,01% (massa) de hidróxido de sódio (ou soda cáustica) , como explicado mais abaixo.
De acordo com especificações técnicas, a concentração da água sanitária pra desinfecção deve ser de pelo menos 0,05% (massa) . Ou seja, no caso de um recipiente com concentração de 2,5% , pode-se diluir 50 vezes. Quer dizer, 1 litro de água sanitária (2,5%) pode ser misturado em outros 49 litros de água, para um total de 50 litros com concentração de 0,05%.
Você poderia perguntar por que não podemos comprar o hipoclorito de sódio na forma sólida (em pó) e prepara nossas próprias soluções. Isso nos economizaria carregar tanta água, e usaria muito menos espaço de armazenamento. A resposta é a seguinte: o hipoclorito de sódio é altamente instável e se decompões de forma explosiva com o aquecimento ou fricção.
Por que se adiciona hidróxido de sódio (ou soda cáustica) na água sanitária?
O hipoclorito de sódio dissone na água liberando o íon ClO− , que é o componente ativo. Este está em equilíbrio químico com o HOCl, ácido hipocloroso e com o Cl2 conforme as equações abaixo:
- HOCl (aq) ⇌ H++ OCl−
- HOCl (aq) + Cl− + H+⇌ Cl2 (aq) + H2O
De acordo com o princípio de Le Chatelier, o equlíbrio pode ser deslocado para um lado ou outro da equação, variando-se, por exemplo, as concentrações.
A adição de ácido , como por exemplo o HCl, desloca o equilíbrio para a direita e portanto aumenta a produção de Cl2 (aq) que está por sua vez em equilíbrio como Cl2 (g). O gás cloro deixa o líquido fazendo com que o equilíbrio se desloque ainda mais para a direita o gás cloro é também um forte oxidante, usado para este fim em diversos processos industriais. Numa situação doméstica o Cl2 (g) é indesejado pois é um gás tóxico e que não poderá ser contido.
Por isso é perigoso misturar na água sanitária outros produtos de limpeza de caráter ácido .
A adição de substâncias alcalinas move o equlíbrio para o lado oposto e favorece a formação do HOCl que se decompóes formando o OCl− , que é o produto desejado, evitando a formação do gás cloro. Por isso adiciona-se hidróxido de sódio à água sanitária.
Por que a água sanitária em contato com os dedos causa uma sensação escorregadia?
É devido à presença de hidróxido de sódio (soda cáustica). Quem já teve contato com soluções diluídas de soda cáustica já notou esta sensação. Isto ocorre devido à reação de saponificação, ou seja, formação de sabão.
Sabão é fabricado a partir de soda cáustica e gordura. No caso, a soda cáustica reage com as gorduras da pele, produzindo sabão, e dando a sensação escorregadia.. Sim, isso significa que parte da sua pele está sendo destruída
outros tópicos relacionados:
A imaginação nos estudos de ciência
